



안정동위원소표지 추적자를 이용한
대사체 연구 방법의 최신 동향
임용현 (한국표준과학연구원 무기분석표준센터장)
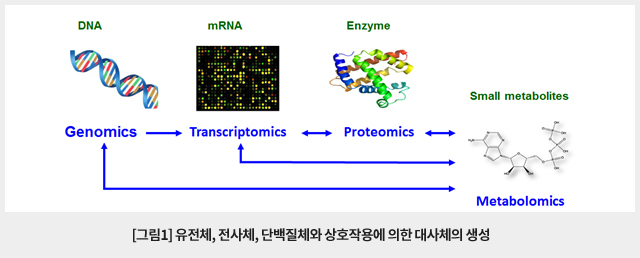
대사체(metabolome)는 세포, 체액, 조직 등 생체를 통해 흡수, 대사, 분배 및 배출되는 수 천종 이상의 저분자 화합물(통상적으로 분자량 1000 Da이하의 화합물)을 통칭하는 말이다. 대사체학(metabolomics) 연구에서는 다양한 유전적, 생리적 또는 외부자극이나 특정 환경 조건에서 유전자, 단백질, 대사산물을 포함한 세포 내 조절작용의 한 요소이자 결과물로서 대사체를 정성 및 정량함으로써 생체 시스템의 생화학적 균형과 변화에 대한 정보를 알아낸다. 2000년대 이후 질량분석법(mass spectrometry, MS)을 포함한 분석기술의 눈부신 발전과 통계적 기법 및 생물정보학의 발전은 대사체의 고속 분석을 가능하게 하고 복잡한 대사체의 패턴에서 유용한 정보를 얻을 수 있게 해 주었다. 대사체학 연구는 생화학적 수준에서 상호작용 및 조절작용의 산물로서 대사체의 변화를 탐구할 수 있어 생명 현상의 기초연구는 물론 질병 기작의 규명, 진단 표지자 발굴, 치료법 개발, 약물 작용 등 다양한 분야에 응용되고 있다.
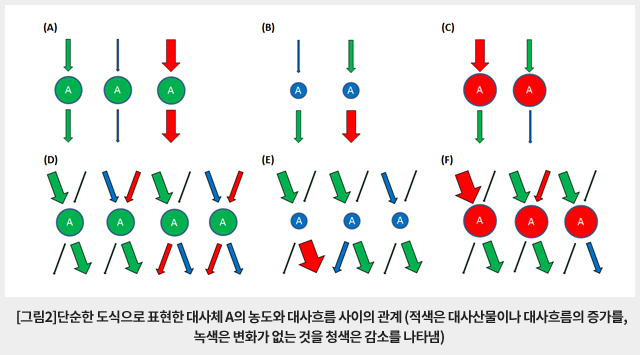
통상적인 대사체학에서 사용하는 대사체 분석방법은 특정 조건에서 생체 시료 중 대사체의 snapshot을 얻어 절대적 또는 상대적 수준을 비교하는 방식이다. 그러나 대사산물의 절대적 또는 상대적 농도는 복잡한 대사경로 상 반응속도의 변화를 정확하게 반영하지 않을 수 있어 의미있는 변화를 감지하지 못하는 경우가 많다. 특히 특정 대사산물의 농도가 다중의 대사경로와 상호작용에 의해 영향을 받는 경우 다양한 다중 경로를 통한 대사흐름(metabolic flux)의 복합적인 결과로 나타나기 때문에 정확한 해석을 어렵게 하며 단순하게 해석하면 오류를 범하기 쉽다. 즉, 그림2의 (A)와 (D)에서와 같이 대사산물의 농도가 변하지 않았다고 해서 관련된 대사흐름의 변화가 없다고 단정할 수 없으며, (B) (C) (E) (F)에서 볼 수 있는 바와 같이 특정 대사산물 양의 증감이 해당 대사산물을 생성하는 대사흐름의 증감만을 의미하지 않는다. 예를 들어, 해당 대사산물을 다른 물질로 바꾸어 주는 대사흐름이 반대로 감소하거나 증가한 결과이거나 또는 다중 대사흐름 변화의 영향일 수도 있기 때문이다. 또한, 대사산물의 pool size가 크면 관련된 대사흐름의 영향을 둔감하게 받게 되므로 대사체의 농도 변화가 거의 없어 대사흐름에도 변화가 없다고 단정하는 오류에 빠질 수도 있다. 정적인 snapshot을 얻는 통상적인 대사체 분석법과 달리 안정동위원소표지 추적자를 이용한 대사흐름 분석법은 대사흐름의 변화와 생체대사의 조절 메카니즘을 이해할 수 있는 가장 효과적인 수단을 제공하여 최근 주목을 받고 있다. 이 글에서는 안정동위원소표지 추적자를 이용한 대사흐름 분석법과 분석 장비의 구성 및 발전 방향을 간략하게 소개하고자 한다.
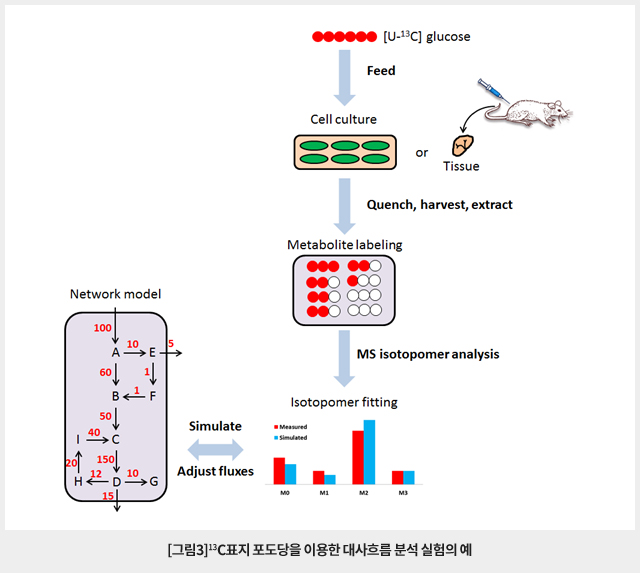
안정동위원소가 표지된 추적자를 세포 배양 배지에 첨가하거나 생체에 주입하면 능동적 또는 수동적 기작에 의해 세포 내외 및 세포 내 소기관으로 흡수 및 배출되고, 세포 내에서 복잡한 상호작용에 의해 조절되는 대사반응에 의해 다양한 대사경로를 따라 안정동위원소표지 대사산물을 생성하게 된다. 대사경로를 따라 확산되는 각 대사산물의 안정동위원소표지 패턴을 질량분석법으로 얻고 추적자의 세포 내 흡수 및 배출 속도와 대사경로에 대한 정보로부터 네트워크 모델을 만들어 비교하면 그림3과 같이 대사흐름에 대한 정보를 얻을 수 있다. 표지를 위한 안정동위원소로 주로 13C를 가장 많이 사용하나 연구목적에 따라 15N이나 2H 표지를 사용할 수 있다. 현재까지 가장 많이 사용되는 추적자는 6개 탄소원자가 모두 13C동위원소로 표지된 [U-13C] glucose이며 주로 glycolysis, pentose phosphate pathway 및 TCA cycle과 같은 central carbon metabolism의 대사흐름을 연구에 사용된다. [U-13C] glutamine은 oxidative와 reductive TCA 대사흐름을 연구하는데 많이 사용된다. 그밖에 lactic acid나 palmitate와 같은 다른 대사산물도 추적자로 사용할 수 있고, 연구목적에 따라서 분자 상 특정 위치 몇 군데만 표지된 추적자를 사용하는 경우도 있다.
안정동위원소표지 추적자를 이용한 대사흐름 분석을 위해서는 먼저 미생물 또는 동물 세포를 배양하는 배지내 추적자와 동일한 영양성분을 안정동위원소표지 추적자로 교환한다. 이 때 추적자 첨가로 인해 배지 조성이 영향을 받지 않도록 배지 교환에 유의해야 한다. Whole organism에 대한 in vivo 실험도 일부 수행되고 있으나 안정동위원소 표지 추적자 실험의 비용이 많이 들고 시스템이 복잡해짐에 따라 데이터 해석에도 어려움이 있다. 추적자의 첨가 후 일정한 시간이 지나면 대사반응이 진행되면서 대사경로를 따라 다양한 대사산물에 안정동위원소가 표지된다. 실험설계에 따라 일정한 시간이 지나면 대사반응을 quench하고 세포 배양액과 세포로부터 대사체를 각각 추출한다. 추출된 대사산물 각각의 양과 안정동위원소 표지 패턴을 뒤에 설명할 다양한 질량분석법으로 얻는다. 안정동위원소 표지 패턴은 질량분석 스펙트럼에서 mass isotopomer 분포로 그림3과 같이 나타난다. 여기서 M0, M1, M2, M3는 화학조성은 동일하나 heavy isotope가 각각 0, 1, 2 및 3개 표지되어 다른 질량으로 질량스펙트럼 상에서 검출된 것이다. 실험적으로 얻은 각 대사산물의 패턴을 대사경로 네트워크 모델에서 대사흐름을 추정하여 이론적으로 얻은 패턴과 비교하고 패턴이 잘 일치하도록 대사흐름을 simulation을 하면 각 대사반응에 대한 대사흐름을 추정할 수 있다. 따라서 정확한 대사흐름 정보를 얻기 위해서는 정확한 대사경로 네트워크에 대한 정보가 확보되어야 한다. 통상적으로 대사흐름 분석은 세포내 대사체와 대사흐름이 거의 변하지 않는 대사평형상태 또는 준평형상태에서 수행한다. 동위원소표지 까지 평형상태에 가까우면 대사흐름 분석이 가장 간단하게 수행될 수 있다 (steady state isotope labeling). 대사체와 대사흐름이 평형상태에 도달하지 않은 시스템에서 대사흐름을 분석하기 위해서는 연구대상 대사경로의 대사속도 수준에 부합하는 여러 시점에서 대사체의 isotopomer 패턴을 얻어야 한다.
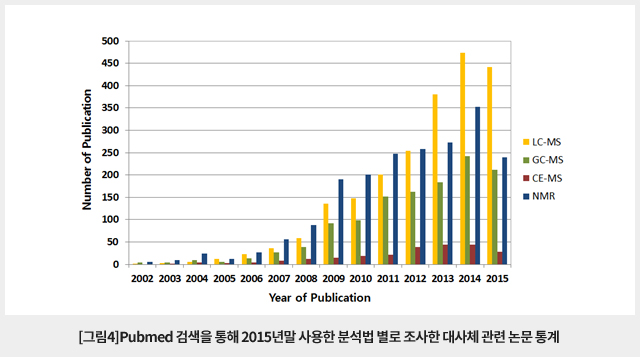
대사체의 분석에는 질량분석법과 핵자기공명법(nuclear magnetic resonance, NMR)이 주로 사용되고 있다. 질량분석법을 이용한 대사체 분석은 NMR의 경우와 마찬가지로 분리분석 없이 고분해능 질량분석기로 대사체 전체를 한꺼번에 분석하는 방법도 가능하나 대부분은 가스크로마토그래피(GC), 액체크로마토그래피(LC) 및 모세관전기영동(CE) 등의 분리분석법을 결합한 방법이 사용되고 있다. 2002년부터 현재까지 Pubmed에 등재된 대사체 분석에 대한 논문을 조사해 보면 그림3과 같다. LC-MS가 가장 많이 사용되고 있으며 GC-MS와 NMR이 그 다음으로 많이 사용되고 있다. NMR은 시료 중 개별 성분을 분리하지 않고도 대사체를 분석할 수 있는 성능을 갖고 있으나 시료 중 성분 농도가 수십-수백 μM이상 되어야 분석이 가능한 단점을 갖고 있어 낮은 농도의 대사체 분석에서는 질량분석법이 널리 사용된다. CE-MS는 가장 사용빈도가 낮으나 낮은 사용빈도가 반드시 대사체 분석에서의 성능을 반영하지는 않는다. 2015년의 경우 2014년에 비해 전체 논문수가 다소 감소된 것은 자료를 조사한 12월말 시점에서 등재 논문 집계가 끝나지 않았기 때문인 것으로 보인다.
LC-MS가 많이 사용되는 것은 대사체 분석에서 가장 일반적으로 사용할 수 있는 방법이라는 점을 반영한다. LC-MS는 다양한 극성과 분자량을 가지는 대사산물을 모두 분석할 수 있는 수단을 제공한다. LC를 이용한 복잡한 대사체의 분리가 충분하지 않기 때문에 크로마토그래피에서 중첩되어 나오는 성분을 구분하기 위해 LC-MS/MS를 사용하거나 LC-MS에 고분해능 MS를 사용해야 한다. LC-MS/MS에도 고분해능 MS를 사용하면 대사체에 대한 신뢰성 높은 정보를 얻는데 도움이 된다. 다양한 대사체를 분석하기에 제한적인 LC의 분리능을 보완하기 위해 역상(reversed phase) LC 외에도 다른 분리 메카니즘을 갖는 다양한 LC 방법이 함께 사용되고 있다. 역상 컬럼을 이용한 LC는 일반적으로 낮은 극성을 갖는 지질류 분리에 좋으나 극성이나 이온성 대사산물 분리는 잘 되지 않는다. 역상 컬럼을 사용하되 이온성/극성물질의 분리 성능을 개선하기 위해 용리액에 ion pairing을 위한 성분을 첨가한 ion paring LC, 최근 이온성/극성물질 분리에 많이 활용되고 있는 HILIC(hydrophilic interaction chromatography) LC 등 다양한 방법을 함께 사용하는 경우도 있다.
GC-MS도 대사체 분석을 위한 좋은 방법 중 하나이나 LC-MS보다 낮은 빈도로 사용되고 있다. 극성이 높고 시료도입부에서 기화가 잘되지 않는 많은 생체분자의 경우 직접 GC-MS로 분석하는 것이 불가능한 경우가 많다. 따라서 시료준비 과정에서 유도체화를 위한 화학반응을 거쳐야 하는데, 이 점이 화학반응에 익숙하지 않은 생물학자나 의학자가 쉽게 접근하기 어렵게 하는 작은 문턱으로 작용할 수 있을 것으로 추정된다. 생체분자 중에는 ATP, NADH, NADPH 등과 같이 안정성이 떨어지거나 열에 약한 것도 많고 유도체화 반응과정에서 변이 가능성이 있는 점도 GC-MS를 이용한 대사체 분석의 한계이다. 그러나 GC가 LC에 비해 분리분석의 분리능이 탁월하므로 GC-MS를 이용한 대사체 분석은 분명한 장점을 갖고 있으며 연구 목적에 따라 아주 좋은 방법이 될 수 있다. GC-MS에서는 전자이온화(electron ionization, EI)를 이용하는데, 분석 성분의 분자량 정보를 주는 분자이온(molecular ion)과 함께 분자이온이 깨져서 만들어진 조각이온(fragment ion)이 만드는 질량스펙트럼의 패턴으로부터 분자구조에 대한 정보도 알아낼 수 있는 점도 장점 중 하나이다. 또한 질량스펙트럼의 패턴을 비교하여 분자를 동정할 수 있는 방대한 라이브러리가 잘 구축되어 있는 점도 GC-MS를 이용한 대사체 분석의 큰 장점이다.
CE-MS는 LC에 비해 뛰어난 분리능을 갖고 있으며 이온성/극성 대사산물의 분석에 큰 장점을 갖고 있다. 극미량 시료로 고감도의 분석을 할 수 있는 것도 또 하나의 장점이다. 이러한 장점에도 불구하고 CE-MS가 널리 사용되지 않는 것은 분석법의 재현성이 낮고 MS와 연결이 안정적이지 않아 분석자의 숙련도에 따라 데이터의 신뢰도가 달라지는 점 때문이다. 그러나 최근 이런 문제점을 개선한 CE-MS 시스템이 개발되어 향후 CE만의 탁월한 장점을 살린 다양한 활용이 늘어날 것으로 기대된다.
앞서 설명한 LC-MS, GC-MS 및 CE-MS 모두 안정동위원소표지 추적자를 이용한 대사흐름 분석에서 사용할 수 있는 질량분석법이다. 그러나 일반적인 대사체 분석과 달리 각 isotopomer를 분리하여 정확하게 검출하여야 하므로 한 대사산물의 isotopomer를 다른 방해물질의 피크와 구분하기 위해 고분해능 질량분석기를 사용하는 것이 좋다. GC-MS와 같이 크로마토그래피의 분리능이 뛰어난 분석법에서는 저분해능 질량분석기를 사용하여도 isotopomer의 분석이 가능할 수 있으나 고분해능 질량분석기를 사용하면 더 양질의 데이터를 얻을 수 있다. 이런 목적의 고분해능 질량분석기로 Orbitrap 질량분석기, 비행시간형(time-of-flight, TOF) 질량분석기 등이 있다. 사중극자형(quadrupole) 질량분석기는 분해능이 낮아 소수의 대사산물에 대해서만 isotopomer 분석을 하는 특수한 경우를 제외하고 적합한 기종이 아니다. 이온사이클로트론공명(ion cyclotron resonance) 질량분석기는 고분해능 질량분석기이나 낮은 분자량(<200-400)의 대사산물의 분석이 어렵고 스캔속도가 느려 LC 이외의 고분리능 분리분석법과 연결하여 사용하기에 적합하지 않다.
안정동위원소표지 추적자를 이용하여 대사흐름을 분석하는 연구를 통해 생물학적으로 의미있고 신뢰성 있는 정보를 얻기 위해서는 적절한 안정동위원소표지 추적자를 선택하고 세포, 조직 및 생체 등 실험 대상에 영향을 최소화할 수 있도록 최적의 실험을 설계하여야 한다. 일반적인 대사체 분석에서와 마찬가지로 대사흐름 분석에서도 시료 채취 및 전처리 과정의 최적화는 실험 결과에 핵심적인 영향을 주는 중요한 요소이다. 대사반응의 quenching 과정에서 대사반응을 최대한 억제하고 세포로부터 대사산물의 leakage를 최소화해야 한다. 세포나 조직으로부터 대사체를 추출할 때 역시 대사산물의 분해나 변환을 최소화하면서 추출효율을 최대화하여야 한다. 실험군과 대조군을 비교하여 통계적으로 의미있는 대사산물 농도의 변화를 찾아내기 위해서는 최적의 normalization 방법도 필요하다.
대사체에 포함된 다양한 대사산물은 세포 내 구역에 따라 농도 편차를 가지면서 구분되어 기능을 수행한다. 그러나 대사산물의 leakage 없이 세포 소기관별 대사체 및 대사흐름을 분석하는 것은 기술적으로 어려운 난제이다. 세포 전체로부터 얻은 대사체 및 대사흐름 정보는 세포질과 각 세포 소기관을 평균한 것으로 세포 내 구역별 대사체 및 대사흐름 정보가 희석된 것이다. 세포 소기관별로 대사체나 대사흐름을 측정할 수 있는 기술이 개발되면 대사체학 연구에 획기적인 발전이 예상된다.
안정동위원소표지 추적자를 이용한 대사흐름 분석은 주로 미생물 세포에 대해 가장 많이 수행되었고, 동물 세포에 대해서도 많이 수행되고 있다. 그러나 개체 전체(whole organism)에 대해 안정동위원소 표지 추적자를 주입하고 추적하는 연구는 비용이 엄청나게 소요되므로 제한적으로 이루어지고 있다.
안정동위원소표지를 이용한 대사흐름 분석은 생체 대사를 연구하기 위한 가장 강력한 도구로 자리잡고 있고 데이터의 신뢰성을 높이기 위한 표준화 작업도 시도되고 있다. 이를 통해 다양한 대사경로 상 대사흐름의 변화를 탐구할 수 있으며 세포 내외 대사산물의 이동에 대한 정보와 결합하면 질병의 기작을 규명하고 진단을 위한 마커를 찾아내는데 유용한 수단을 제공할 수 있을 것으로 기대한다.

Copyright(c) Korean Endocrine Society. All rights reserved.