



신경세포 (Neuron)와 비신경세포 (Glia)의 상호작용 연구를 통한 뇌 기능의 이해
이창준 (한국과학기술연구원(KIST) 신경교세포연구단장)
지난 100년 동안, 뇌의 기능에 관한 연구는 주로 신경세포 (Neuron) 위주로 이루어져 왔다.뇌의 신경세포의 역할은 외부 환경을 감지한 신호 정보를 받아들이며 전달하는 것으로 알려져 왔다. 실제로 신경계에 관한 생리적/병리적인 이해는 대부분이 주로 신경세포의 기능 연구를 통해 이루어져 온 것이 현실이다. 하지만, 뇌의 기능을 연구하는데 있어 이러한 신경세포 위주의 접근법은 우리의 뇌가 어떤 기작으로 일상의 외부 자극을 인지 기능의 높은 단계로 전달하는 지에 대한 충분한 이해를 주는데 한계가 있으며, 이에 더해 지금까지 신경세포 위주의 연구를 바탕으로 제시된 뇌 질환치료제 후보들 (예를 들어, 퇴행성뇌질환, 뇌졸중, 머리 및 척수 외상 등)이 실패한 사례가 많이 있다는 사실은 현 과학계에 시사하는 바가 크다. 실제로 많은 뇌질환 현상들은 신경세포뿐만 아니라 비신경세포인 신경교세포(Glia)의 이상을 동반하기도 한다. 본 연구단은 그 동안 상대적으로 관심 받지 못한 비신경세포, 특히 신경교세포 중 성상아교세포 (Astrocyte)의 기능을 중점적으로 연구함으로써, 뇌 기능의 전반적인 생리적/병리적 기작을 이해하고자 한다.

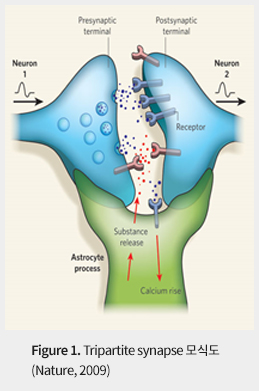
비신경세포인 신경교세포 (Glia)는 성상아교세포 (astrocyte), 미세아교세포 (microglia), 희소돌기아교세포 (oligodendrocyte)로 나뉘어 지며, 이는 숫자적으로 뇌에서 존재하는 세포들 가운데 가장 많은 세포군 중에 하나이다. 그리고 이러한 신경교세포는 신경세포와의 밀접한 기능적 연결을 통해 신경세포의 신호전달을 조절한다고 알려져 왔다. 최근 발견에 의하면 신경교세포가 신경세포의 기능적 단위인 시냅스 (Synapse)와 위치적으로 인접(이를 Tripartite Synapse라 한다, Figure 1) 하고 있으며, 여러 가지 신호전달물질 (Glutamate, GABA, D-Serine, ATP)들을 분비하는 것으로 알려져 있다. 이는 신경교세포의 다양한 신경전달물질 분비에 따라 주변 신경세포가 조절되고, 이로 인해 다양한 뇌의 기능으로 조절 될 수 있다는 것을 시사한다.
앞서 언급한 바와 같이 뇌의 전반적인 이해를 위해선 신경세포와 신경교세포의 상호작용의 이해가 필수적이지만 신경교세포와 신경세포와의 상호작용을 연구함에 있어 문제가 되는 것은 교세포에서 분비되는 신호전달물질을 선택적으로 탐색/측정/연구하는데 있다. 물질의 분비를 탐색하는 기술로는 HPLC, 효소기반적탐색법 (enzyme assay)이 주로 쓰이고 있는 상황이다. 하지만 이러한 고전적 방법은 정확한 분비 기작을 이해하는데 한계가 있다. 예를 들어 대표적 신경전달물질인 Glutamate를 탐색하는데 있어 HPLC와 효소기반적 탐색 등은 간접적이고 시간적인 정보를 제공하지 못하여 실시간 탐색하기에는 부적합하며, 적절한 탐색기술의 부재로 성상아교세포(astrocyte)의 glutamate 분비 기작은 많은 논쟁을 야기해왔다.
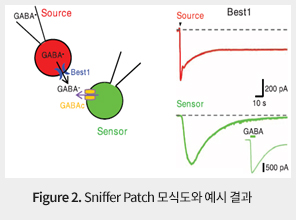
실제로 본 연구실은 최근에 현존하는 가장 적절한 방법인 바이오센서를 이용한 전기생리학적 신호전달물질감지방법인 sniffer patch를 (Figure 2) 이용하여, 성상아교세포의 Glutamate와 GABA는 소포체 (Vesicle)를 이용하여 분비되지 않고, 이온채널 (Ion channel)을 통하여 분비되고 있음을 최초로 확인/규명하였다. 이 sniffer patch 방법을 통하여 Glutamate, GABA, D-Serine, ATP, BDNF 등 다양한 신호전달물질의 분자적 분비 기전을 연구하고 있다. 또한, 비신경세포 혹은 신경세포에 발현된 다양한 유전자를 선택적으로 제한하는 분자 유전학적 기술인 세포특이적 유전자 조절기술 (cell type specific gene silencing down system)과 이를 발현하는 바이러스의 제작/생산 및 뇌내 주입기술을 이용하여 신경세포 혹은 신경교세포에서 분비되는 신호전달물질을 선택적으로 구분하여 억제가 가능하며, 신경세포 혹은 신경교세포 특이적으로 빛에 반응하는 마우스를 보유하고 있다. 또한, 다양한 전기 생리학적 기술과 이미징 기술을 이용하여 각각 세포의 기능을 생리적과 병리/생리학적인 관점에서 비교 분석하여 연구함으로써, 신경교세포의 특정 이온채널을 통해 신경전달 물질의 분비가 신경세포의 시냅스 전달 및 가소성에 필수적인 영향을 미침을 기억의 저장소로 알려진 해마와 신체운동을 조절하는 소뇌에서 밝혀냈으며, 다양한 뇌질환 (우울증, 중독, 수면장애, 외상성뇌손상, 알츠하이머병, 파킨슨병, 헌팅턴병, 루게릭병, 뇌졸중, 다발성경화증 등)의 병리학적 기전을 연구하고 있다. 또한 신경세포와 신경교세포와의 시냅스 (Synapse) 에서의 물리적 접촉을 관찰하기 위하여 최신 기술인 광유전학적 기술(Optogenetics)을 접목하여 살아있는 뇌에서의 신경세포와 신경교세포간의 기능적 연결지도 작성을 추구하여 뇌의 생리적/기능적 현상의 이해를 도모하고, 또한 지금까지 해결하지 못한 많은 뇌 관련 질환 치료법의 근간을 제시하고자 한다.
| 연구내용 |
|
|---|---|
| 연구기법 |
|

Copyright(c) Korean Endocrine Society. All rights reserved.