



대사 질환 발생에 있어서 염증반응의 역할 및 기전에 대한 연구
조계원(순천향대학교 의생명연구원(SIMS))
비만과 제2형 당뇨병을 포함한 대사 질환의 유병률은 우리나라를 포함하여 전 세계적으로 급증하고 있다. 대사 질환들은 만성적인 염증반응과 관련이 있고, 이러한 현상은 전신적으로 또는 조직별로 관찰되고 있다. 특히, 비만은 만성적으로 낮은 수준의 염증상태를 보이고 있으며, 이는 지방조직 내 염증세포의 축적 및 변화에 의해 시작되고 조절됨이 밝혀졌다. 만성적인 지방 조직 염증은 지방세포의 인슐린 저항성을 유도하고, 지방조직의 잉여 에너지 축적 기능을 저해한다. 따라서, 지방 조직 내 염증은 비만에 의한 동반 대사질환 (제 2형 당뇨병, 심혈관 질환)의 발생의 병태생리학적 기전으로 제시되고 있으며, 많은 연구그룹들이 지방염증의 역할 및 조절 기전을 밝히고자 노력하고 있다.
지방조직에는 다양한 면역세포들이 존재하며, 이들 면역세포들의 축적과 형태의 변화를 통해 비만에 의한 지방염증을 조절한다 (그림 1). 내재 면역계의 주 세포인 대식세포는 건강하고 마른 지방조직에서 항염증 기능의 M2 형태로 존재하며 조직 항상성을 유지한다. 하지만 비만을 유도하게 되면, 지방조직에는 전염증성 M1 형태의 대식세포가 침윤하여 축적된다. M1 지방대식세포(Adipose Tissue Macrophage, ATM )는 CD11c를 발현하고 있으며, 많은 양의 염증성 사이토카인을 생성한다. 비만의 지속적인 발달에 있어 M1 ATM이 M2 ATM보다 압도적으로 수가 많아지며, M1/M2 ATM 균형의 변화에 의한 염증성 사이토카인의 증대와 지방염증이 유도된다.
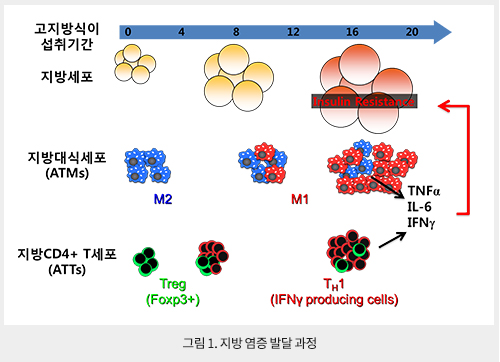
적응면역계 CD4+ T 림프구 또한 지방조직에 존재하고 있으며, 비만에 의해 분화형태와 축적이 조절된다. 마른 지방조직 내 주요 CD4+ T 세포는 조절 T세포 (regulatory T cell; Treg)이나, 고지방식이의 섭취에 따라 Treg 수는 감소하며, interferon- (IFN)를 생산하는 Th1 세포는 증가된다. IL-10을 생산하는 조절 T세포는 항염증 기능을 지니고 있으며, Th1세포는 염증 증대 역할을 한다. 즉, 비만에 의한 지방 CD4+ T림프구 (Adipose Tissue T lymphocytes, ATT)의 Th1/Treg 불균형은 지방염증 및 인슐린 저항성 발달에 기여한다.
비장과 림프절의 T세포와 달리 비만 지방조직 ATT는 매우 제한적인 T세포 수용체 다양성을 지니고 있으며, Th1세포의 증가가 M1 ATM의 축적보다 먼저 일어나는 등의 순차적 진행의 특성을 나타낸다. 이러한 결과들은 내재면역과 적응면역이 서로 상호작용하여 지방조직의 만성염증반응을 조절함을 의미하며, 어떻게 염증 신호 체계가 ATT로 전달되어 지방염증을 유도하는지에 대한 질문들을 제기한다.
적응면역의 주역 세포인 T 세포 반응의 방향 및 정도는 항원제시세포 (Antigen Presenting Cell)와 T세포간의 항원제시경로 (Antigen Presentation Pathway)에 의하여 전적으로 좌우된다. T세포의 활성화는 미접촉 T세포 (naïve T cell)가 항원제시세포의 MHC-II:항원 복합체를 만나면서 이루어지며, 항원제시세포의 co-stimulatory signal 및 cytokine이 T세포의 Treg, Th1, Th2, Th17으로의 분화 및 활성화 정도를 결정한다. 본 연구실에서는 지방조직 내 내재면역과 적응면역의 상호조절에 있어 항원제시경로의 역할 및 조절에 관심을 두고 연구를 진행하고 있다.
ATM은 항원제시세포의 능력을 지니기 위한 MHC II와 co-stimulatory 수용체 분자들을 발현하고 있으며, 항원 포식과 MHC-II로의 항원표식 능력이 있다. 또한, 비만에 의해 ATM의 항원제시능력은 증가되며, 이와 일치하게 항원특이 ATT의 증식(proliferation)이 증대된다. 특히, 대식세포의 MHC II를 결핍하거나 MHC-II 항체를 주입하여 ATM의 항원제시능력을 차단하였을 경우 비만에 의한 지방염증과 인슐린 저항성이 개선된다. 이러한 효과는 지방조직 내 Treg의 증가와 Th1의 저하와 관련이 있다. 이는 항원제시경로가 ATM과 ATT간의 상호조절 기전이며, ATM의 항원제시경로에 의한 ATT의 활성, Th1 ATT에 의한 M1 ATM의 침윤 증대를 통한 비만 유래 지방염증 발달의 모델을 제공한다 (그림 2).
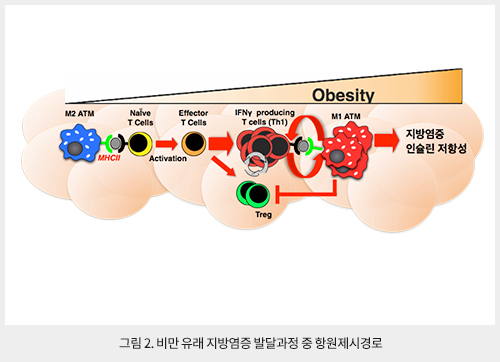
지방염증 발달에서 항원제시경로의 역할 규명은 ATM과 ATT을 포함한 다양한 면역세포들(수지상세포, B세포 등)의 단편적인 변화를 통합적으로 이해하게 한다. 더불어, 대사질환 특이 항원 존재의 가능성 및 대사질환에서의 항원제시경로 조절 기전 연구의 필요성을 제시한다.
본 연구실은 순천향대학교 순천향의생명연구원 (SIMS) 내에 위치하고 있으며 대사질환 발생 및 조절에 중요한 지방염증의 기능 및 기전을 밝혀내기 위한 다양한 연구를 진행하고 있다. 그 중 일부를 요약하여 여기에 소개하였는데, 이러한 노력은 대사질환 발병의 새로운 지식을 창출할 뿐 아니라 비만 동반 대사질환을 치료할 수 있는 새로운 방법을 개발하는 데에도 기여할 것으로 기대된다.
Cho KW, Zamarron BF, Muir LA, Singer K, Porsche CE, DelProposto JB, Geletka L, Meyer KA, O’Rourke RW, Lumeng CN (2016) Adipose tissue dendritic cells are independent contributors to obesity-induced inflammation and insulin resistance. Journal of Immunology, 197 (9): 3650-3661
Cho KW, Morris DL, DelProposto JL, Geletka L, Zamarron B, Martinez-Santibanez G, Meyer KA, Singer K, O’Rourke RW, Lumeng CN (2014) An MHC II-dependent activation loop between adipose tissue macrophages and CD4+ T cells controls obesity-induced inflammation. Cell Reports, 9(2): 605-617
Morris DL, Cho KW, Delproposto JL, Oatmen KE, Geletka LM, Martinez-Santibanez G, Singer K, Lumeng CN (2013) Adipose tissue macrophages function as antigen-presenting cells and regulate adipose tissue CD4+ T cells in mice. Diabetes, 62(8): 2762-2772


Copyright(c) Korean Endocrine Society. All rights reserved.