



연세대학교 의과대학 의생명과학부
세포대사 연구실
황성순(연세의대 의생명과학부)
연구실 요약
본 연구실은 세포의 에너지대사를 제어하는 다양한 신호체계를 중심으로 비만, 지방간 및 당뇨 등의 대사질환, 그리고 종양의 미세환경에서 나타나는 세포 대사기전을 연구하고 있다. 세포의 에너지 대사는 세포 내의 에너지 발전소로 여겨지는 미토콘드리아에서 일어나는 것뿐만 아니라, 미토콘드리아에서 일어나는 에너지대사에 필요한 다양한 대사체를 생산하는 분자기전도 모두 포함한다. 세포의 에너지로 가장 많이 사용되는 포도당은 세포에서 해당과정을 거쳐 피루브산을 만들고, 이후 피루브산이 미토콘드리아로 전달되어 전자전달계를 거쳐 에너지를 생산하게 된다. 탄수화물로 대표되는 포도당뿐만 아니라, 세포의 에너지원으로 사용되는 영양소는 지방산 및 단백질도 포함된다. 따라서 탄수화물, 지방, 그리고 단백질을 이용하여 에너지를 생산하는 세포의 대사기전은 생명을 유지하는 필수적인 메카니즘으로, 이들 세포의 대사기전을 제어하는 다양한 유전자의 기능을 밝히는 것은 세포 대사기전과 관련된 다양한 질환을 치료할 수 있는 새로운 치료전략으로 제시할 수 있다. 본 연구실은 세포의 에너지대사를 제어할 수 있는 세포 외부의 신호전달체계를 중심으로 연구를 진행하고 있다.
호르몬에 의한 신호전달체계
호르몬 신호체계는 세포 외부로부터의 가장 중요한 신호전달체계라 할 수 있다. 호르몬에 의한 신호전달체계는 크게 두 가지로 나누어지는데, 세포막에 존재하는 호르몬 수용체 (막수용체)와 세포 내에 존재하는 호르몬 수용체 (핵수용체)가 그 역할을 담당한다. 일반적으로 세포막에 존재하는 막수용체는 신호전달기전에 따라 kinase 계열과 G protein-coupled receptor로 나뉘어지며 세포 외부로부터 전달받은 신호를 signal transduction을 이용하여 핵 내로 신호를 전달한다1,2.
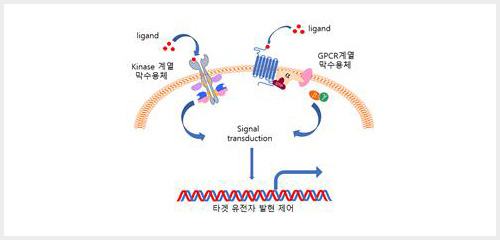
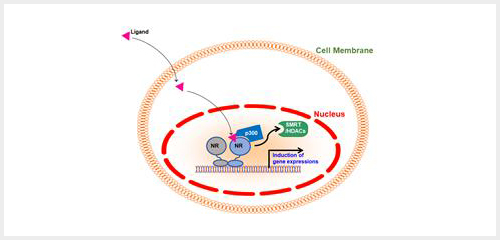
막수용체와는 달리, 지질계열 혹은 스테로이드 등의 호르몬은 세포막을 통과하여 세포 내에 존재하는 핵수용체와 결합하여 핵으로 신호를 전달하게 된다. 핵수용체는 DNA binding-domain (DBD)을 지니고 있으며, 이들 DBD는 각각 특이적인 DNA 염기서열을 인식하여 핵수용체가 DNA에 직접적으로 결합할 수 있게 한다. 일반적으로 리간드와 결합하지 않은 핵수용체는 SMRT/HDAC등의 전사억제인자와 결합하여 타겟 유전자의 프로모터를 비활성화하여유전자 발현을 억제한다. 그러나 리간드가 세포내로 들어와 핵수용체와 결합하게 되면, 핵수용체는 p300등의 전사활성인자와 결합하여 타겟유전자의 발현을 증가시킨다3.
막수용체와 핵수용체를 이용한 담즙산 신호전달체계
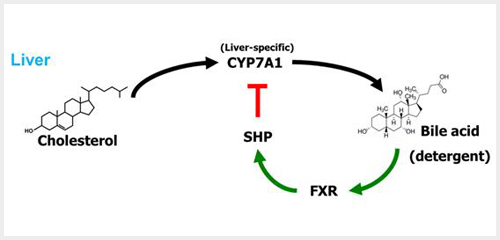
소화액으로 잘 알려진 담즙산은 일반적으로 간에서 콜레스테롤이 분해되며 생성된다. 간에 특이하게 존재하는 Cholesterol 7alpha hydroxylase (CYP7A1)은 콜레스테롤을 담즙산으로 분해하는 유전자로서, 콜레스테롤을 분해하여 담즙산을 합성하는 과정에서 가장 중요한 효소이다4.
담즙산은 소화액뿐만 아니라 세포내에 존재하는 수용체와 결합하여 다양한 세포내 신호체계를 제어할 수 있다. 가장 잘 알려진 담즙산 수용체로는 TGR5를 들 수 있는데, TGR5는 세포막에 존재하는 담즙산 막수용체로서 G protein-coupled receptor 계열이다. 다른 GPCR 수용체와 마찬가지로 TGR5는 담즙산과 결합하면 cAMP 신호체계를 활성화시켜 세포 내로 신호를 전달한다. TGR5는 다양한 조직에서 발현되며 여러 세포기전을 제어하는데, 세포대사를 제어하는 기전 중에서 가장 잘 알려진 기전은 갈색지방세포의 기능을 활성화하여 에너지대사량을 증가시키는 기전이다. 갈색지방세포막에 존재하는 TGR5가 담즙산과 결합하게 되면 갈색지방세포 내에 존재하는 cAMP 신호체계가 활성화되는데, 그 결과 Dio2 유전자가 증가하며 비활성화된 갑상선 호르몬 (T4)를 활성화된 갑상선 호르몬(T3)으로 변환하게 된다. 그 결과 담즙산이 TGR5를 활성화시키면 갈색지방세포 내에서 갑상선 호르몬 신호체계가 활성화되면서 국소적으로 갈색지방 내의 에너지대사가 매우 활발하게 진행된다. 특히 갈색지방은 thermogenesis 기전을 이용하여 발열반응을 일으키는데, 체내에 담즙산 수치가 높아 갈색지방의 TGR5를 활성화시키면, 에너지대사량을 증가시켜 항비만 효과를 얻을 수 있다5.

세포막에 존재하는 TGR5와는 달리 Farnesoid X receptor (FXR)은 핵수용체로서 세포 내로 들어온 담즙산과 결합한 후, 타겟 유전자의 프로모터부위에 직접적으로 결합하여 유전자 발현을 제어함으로써 세포의 다양한 대사기전을 조절한다. FXR은 담즙산과 결합하여 small heterodimer partner (SHP) 유전자의 발현을 유도, 담즙산을 생성하는 효소인 CYP7A1을 억제하는 기능으로 매우 잘 알려져 있다. 담즙산 생성기전을 제어하는 기능 이외에도 FXR은 세포의 대사를 제어하는 기능이 밝혀졌다. 특히 간에서의 지방대사를 억제하는 기전이 밝혀졌으며, 그 결과 FXR의 기능이 활성화되면 간에서 지방을 합성하는 lipogenesis를 억제하여 지방간을 억제할 수 있음이 연구결과로 보고되었다6.
FXR을 기반으로 하는 담즙산 신호체계가 hepatic lipogenesis를 억제함에 따라, FXR을 활성화시킬 수 있는 새로운 물질들이 최근 새로운 지방간 및 지방간염의 치료제로 떠오르고 있다. 2017년 미국 FDA로부터 Primary biliary cholangitis (PBC) 치료제로 승인받은 obeticholic acid는 환자에게 투여가 가능한 최초의 담즙산 기반 치료제로서 PBC 뿐만 아니라 최근 지방간 및 지방간염 치료를 위한 임상시험이 진행 중이다. 그 외에도 Novartis, Gilead 등의 다양한 제약사에서 지방간 및 지방간염 치료제로 FXR agonist를 개발중이며 임상시험을 진행하고 있다. 이들은 모두 FXR의 기능을 활성화하여 간에서의 지방합성 및 염증반응을 억제함으로써 지방간과 지방간염을 개선하는 약물로 개발 중이다.

맺음말
담즙산 신호체계는 위에서 언급한 대사질환 뿐만 아니라 암 세포의 암화과정 및 전이과정에도 영향을 미치는 것으로 알려져 있다. 특히 담즙산은 다양한 암에서 매우 중요한 역할을 담당하는 β catenin 신호체계를 억제할 수 있기에, 담즙산 신호체계는 암을 치료하는 새로운 치료전략으로 떠오르고 있다. 본 연구실은 담즙산 신호체계에서 중요한 역할을 담당하는 다양한 전사인자를 중심으로 암세포의 생존 및 사멸, 그리고 면역세포와의 상호작용에서 담즙산 신호체계의 기능을 살펴보고 있다.


Copyright(c) Korean Endocrine Society. All rights reserved.