



영남대학교 의과대학 당뇨병 · 췌도연구실험실
문준성(영남의대 영남대병원 내분비내과)
우리 몸의 포도당 대사항상성을 유지하기 위해 여러 장기들이 긴밀하고 정교하게 작동하고 있고, 그 중 인슐린과 글루카곤의 구조와 역할이 밝혀진 이래로 많은 학문적 진보가 이뤄져 왔다. 특히 췌도에서 인슐린의 합성과 분비는 당대사의 유지에 필수적인데, 우리나라를 비롯한 아시아에서 급증하고 있는 당뇨병의 발생에 있어 인슐린분비능의 저하가 핵심적인 병태생리라는 사실이 점차 밝혀지고 있다. 하지만 당뇨병 발생 기전에 있어 베타세포기능부전에 대해서 아직 더 많은 연구들이 필요한 실정이며, 향후 중요한 치료 타겟으로써 지속적인 노력이 필요한 분야이다. 본 연구팀은 임상진료를 바탕으로 당뇨병 발생과 악화에 있어 췌장베타세포기능부전의 기전 및 치료 목표를 발굴하고자 하는 연구를 지속해 오고 있다.
당뇨병에서 베타세포 기능부전의 병태생리
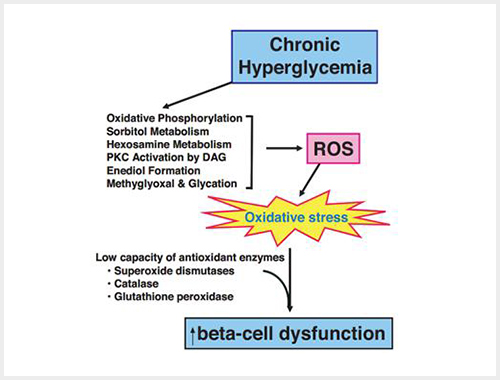
호과도한 영양섭취는 비만 및 고혈당, 고지혈증을 유발한다. 만약 이런 상황이 만성적으로 지속되면 비정상적으로 높은 포도당과 지방산이 베타세포에서 더 이상 인슐린 분비를 자극하는 신호로서 영양소가 아닌 독성으로 작용하게 된다. 이를 당독성 (glucotoxicity)과 지질독성 (lipotoxicity) 라고 하며, 두 가지 모두 복합적으로 당지질독성 (glucolipotoxicty)라고 한다. 이 과정에서 미토콘드리아 및 세포질에서 과도한 활성화 산소종 (Reactive Oxygen Species, 이하 ROS)가 생성되게 되는데, 베타세포에서 항산화 기능을 담당하는 효소의 양이 적어 ROS 처리능이 타 장기보다 매우 낮다고 알려져 있다. 따라서 다른 장기에 비해 산화스트레스에 더 취약한 것이 당뇨병 발생에 있어 인슐린 분비능의 감소를 유발하는 원인 중 하나이다. 실험적으로 인슐린 생산 췌도세포주 등을 이용하여 고농도 포도당 환경에 72 시간 동안 노출시켰을 때 시간, 용량 의존적으로 세포들의 사멸을 관찰하였고 포도당 자극 후 인슐린 분비량 (Glucose stimulated insulin secretion, 이하 GSIS)이 유의하게 감소하는 것을 보고한 바 있다. 반대로 항산화제를 처리했을 때 세포사멸이 감소하고 인슐린 분비능이 회복하였다. 따라서 과도한 영양소 노출에 대한 산화스트레스를 감소시키는 것이 당뇨병 환자에서 베타세포를 보호하는 중요한 전략이 될 수 있다. 이후 세포 수준에서 밝혀진 기전을 토대로 항산화제를 이용하여 당뇨병을 예방 및 개선하려는 임상연구들이 시도되었으나 대부분 인체를 대상으로 한 연구에서는 당뇨병 발생이나 악화를 효과적으로 예방하지는 못하였다. 따라서 산화스트레스를 감소시키는 전략이 베타세포 관점에서는 중요하나, 다른 여러 요인들이 복잡하게 관여할 것으로 생각되고, 베타세포의 기능을 보존하기 위한 효과적인 타겟의 발굴이 중요할 것이다.
당뇨병과 Fatty acid translocase/Cluster determinant 36 (FAT/CD36)
Cluster determinant 36 (이하 CD36)은 주로 세포막에 분포하여 지방산을 세포내로 이동시키는 지방산수송체의 역할을 하는 것으로 잘 알려져 있다. 심근, 골격근 등에 주로 분포하나 적혈구, 혈소판 등에도 발현하며 다양한 부위에서 다양한 리간드와 결합하여 작용하며, 비만, 다낭성 난소증후군, 지방간, 동맥경화증 등 인슐린 저항성의 증가와 관련된 여러 대사질환과 관련이 있는 것으로 알려져 있다. 또한 최근에는 췌장암 등 종양의 전이에 있어서도 중요한 역할을 한다고 보고되어 앞으로도 CD36 의 역할에 대해 관심이 높아지고 있다. 세포막에 표현되는 형태 뿐 아니라 혈장에서도 CD36을 측정할 수 있는데, 본 연구진은 혈액에서 측정한 값을 가지고 정상인, 전당뇨병, 당뇨병 군에서 기존에 알려진 TyG index보다 중성지방 값을 CD36으로 대체한 지표가 대사상태와 밀접하여 가치 있는 지표로 사용될 수 있음을 EnM저널을 통해 발표한 바 있다.
베타세포에서도 역시 CD36은 발현되나 그 기능에 대해서는 잘 알려진 바가 없었는데, 본 연구팀에서 흥미롭게도 glucotoxicity 조건 하에서 CD36의 발현이 증가하였고, 증가된 CD36은 추가적인 지방산의 처리가 없었음에도 세포내 지방산의 유입을 증가시킴을 관찰하였다. 이는 부가적인 lipotoxicity를 초래하였을 가능성이 있고, CD36 의 발현을 siRNA로 억제후 손상된 인슐린 분비능이 부분적으로 회복함으로써 CD36의 발현이 당뇨병 환경에서 베타세포부전과 관련이 있을 것이라고 생각하였다. 이후 다른 연구에서 임상에서 사용 중인 metformin 과 ezetimibe의 처리 후에 CD36의 발현이 감소하고, 세포사멸 및 GSIS를 회복됨을 in vitro 에서 확인함으로써 전술한 약제의 사용이 당뇨병의 치료에 또 다른 측면으로 도움이 될 것으로 보인다.
Ceramide 독성과 CD36
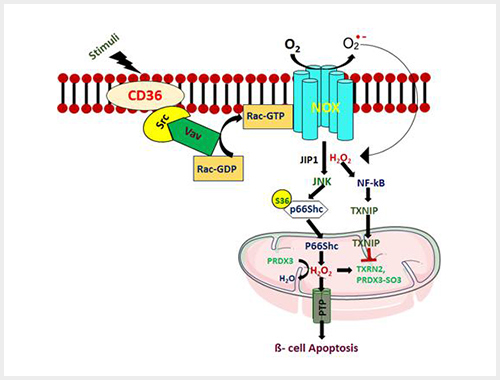
세포 내 과도한 ROS의 처리에 중요한 단백질 중 Thioredoxin을 불활성화시키는 thioredoxin- interacting protein (TXNIP)은 당뇨병의 베타세포기능부전에 중요한 역할을 하는 것으로 잘 알려져 있다. 고농도 포도당을 비롯한 다양한 요인에 의해 증가된 TXNIP은 베타세포기능부전을 유발하고 발현을 억제할 때 회복되므로 당뇨병의 중요한 치료타겟으로 생각된다. 본 연구팀은 당뇨병 환경에서 세라마이드의 과다한 생성과 축적이 발생하고 이를 통해 베타세포에 나쁜 영향을 미치나 그 기전에 대해서는 잘 알려져 있지 않기에 당뇨병과 밀접한 관계가 있는 세라마이드와 TXNIP의 관계에 대해 연구를 진행했다. TXNIP은 지방산에 의해서 증가하지는 않지만 흥미롭게도 INS-1 세포주에 C2 ceramide(세포막 투과형)를 처리했을 때 CD36이 증가하고 이어 TXNIP 또한 증가함을 확인할 수 있었다. CD36를 저해하는 Sulfo-N-succinimidyl oleate (SSO)를 처리 후 TXNIP의 전사와 단백질발현 및 활성화가 감소한 결과를 통해, Ceramide의 과도한 축적이 CD36의 증가를 통한 TXNIP의 활성화 시켜 베타세포 사멸 및 기능부전에 관여함을 확인하였다. 또한 CD36의 조절이 당뇨병 환경 하에서 베타세포기능 보전의 중요한 전략이 될 수 있음을 시사한다고 결론내릴 수 있었다.
CD36 과 Rac1-NADPH Oxidase
Small GTPase 인 Rac1은 베타세포에서 인슐린의 세포외분비 (exocytosis)에 중요한 역할을 할 뿐 아니라 당뇨병 환경에서 증가 시 NADPH oxidase (NOX) 2 를 과도하게 활성화시켜 비정상적으로 ROS를 생성시키고 이로 인해 베타세포기능부전 및 사멸을 촉진한다고 알려져 있다. 이전 연구에서 과도한 ROS가 CD36의 발현을 증가시키는 것에 착안하여 Rac1 과 CD36 간의 관계에 대하여 알아보고자 하였다. INS-1 세포주에 고농도포도당을 처리하였을 때 Rac1 의 활성화는 NOX 활성을 유발하고, 이에 따라 과도하게 증가된 ROS 와 함께 인슐린분비저하 및 세포사멸이 증가함을 확인했다. 또한 ROS 증가는 CD36 의 발현 뿐 아니라 세포막으로의 이동을 증가시키면서 스트레스를 조장하였다. 하지만 Rac1 및 NOX2 억제제의 처리는 CD36의 발현을 감소 및 ROS를 감소시키는 결과를 보여주어 Rac 1-NOX와 CD36이 당뇨병환경에서 밀접한 연관이 있으며 이들이 향후 당뇨병 치료에 중요한 역할을 할 것으로 생각되었다.
이러한 일련의 과정들은 과도한 스트레스 상황에서 산화-환원 과정에 대해 유기적으로 작동하면서 영향을 미치는 것을 redoxosome이라 하는데, 본 연구실은 redoxosome의 제어와 당뇨병 치료에 대해 향후 연구를 지속할 예정이다. 최근에는 스트레스 상황을 감지하고 제어하여 세포 내 적응을 감지하는 p66shc가 이런 redoxosome의 활성화와 밀접한 관련이 있고, 이런 세포 내의 signaling pathway를 통합적인 개념으로 접근하는 시도를 하고 있다.
연구실 소개
본 연구실은 원규장 교수님을 지도교수로 모시고, 필자인 저를 포함해 정승민 (임상조교수) 선생과 Udayakumar Karunakaran 박사, Elumalai Suma 박사 부부 5 명으로 이뤄져 있다. 비교적 인원수는 작지만 선택과 집중을 통해 최근 수년 간 췌도베타세포 연구분야에 당뇨병의 병태생리기전과 치료법 개발을 위해 노력하고 있다. 또 한국연구재단으로부터 신진연구 및 중견연구자 지원을 수혜받아 연구를 지속해오고 있으며, 최근 지역거점형 혁신형의사과학자공동연구사업에 정승민 선생이 세부책임을 맡아 환경호르몬과 베타세포기능부전의 기전에 대해 연구를 지속할 예정이다.
췌도 연구는 베타세포를 동물에서 분리하고 얻는 데 있어 다른 장기보다 까다로운 면이 있어 결코 쉽다고는 할 수 없겠지만, 당뇨병 분야에서 췌도분야 연구의 중요성은 아무리 강조해도 지나침이 없다고 생각한다. 또한 인슐린 분비능 저하가 한국인 당뇨병발생의 중요한 기전임이 최근 연구들을 통해 점차 밝혀지고 있기 때문에 더 많은 회원들이 관심을 가지고 어떻게 인슐린분비능을 보존할 것인가에 대한 연구가 더 많이 이뤄져야 한다고 생각된다. 아무쪼록 젊은 연구자들이 이 분야에 더 많은 관심을 가져주시고 연구한다면 당뇨병 정복에 한 걸음 더 가까이 다가가지 않을까 생각해 본다.
지면을 빌어 그동안 연구에 물심양면으로 많은 도움을 주신 경북의대 이인규 교수님과 고베대학교의 Susumu Seino 교수님, 그리고 대한당뇨병학회 베타세포연구회의 모든 교수님들께 감사의 말씀을 전한다.



Copyright(c) Korean Endocrine Society. All rights reserved.