



NLRP3 인플라마좀 경로를 통한
골소실 연구
고정태 (전남대 치전원 치과약리학교실)
본 연구실은 전남대학교 치의학전문대학원 치과약리학교실 및 경조직바이오인터페이스 연구센터(MRC)에 소속되어 있으며, 염증·대사질환에서의 골소실과 분자적 기전, 중간엽줄기세포의 분화 및 골재생에 관한 연구를 수행하고 있다. 고령 동물, 치주염/당뇨병 모델 동물, 유전자 변형 마우스와 유사 조건의 세포 실험 모델을 사용하여 세균 감염, 노화, 당뇨병 질환에서의 염증에 의한 골소실 기전과 치료적 접근 방법을 밝히고자 노력하고 있다.
염증 반응은 외부 병원체 침입과 신체 내 이상 변화를 감지하고 경고 신호를 발생하는 일차적인 신체 방어 작용이다. 유해 인자에 대해 염증 반응을 유발하는 주된 세포로는 대식세포, 호중구 및 상피세포 등이 있으며, 그 결과로 국소 부위의 발열과 특정 세포의 기능 변화 및 사멸 등을 초래한다. 대식세포와 같은 면역세포는 특정 수용체(패턴인식 수용체, pattern recognition receptors, PRRs)를 통하여 병원체에서 유래하는 분자패턴 (pathogen-associated molecular patterns, PAMPs) 또는 손상 세포에서 유래하는 위험-연관 분자패턴(danger-associated molecular patterns, DAMPs)을 인지하고, 이후 복잡한 세포 내 신호전달을 거쳐 인플라마좀(inflammasome) 복합체를 활성화하고 IL-1β와 IL-18를 분비한다. 이러한 반응은 기본적으로 외부 미생물을 제거하는 데 유용하지만, 세포 내 위험 인자에 의한 과도한 인플라마좀 활성은 당뇨병와 같은 대사 질환, 류마티스 관절염, 알츠하이머, 암 진행 등의 병적 상황을 악화시키기도 한다.
인플라마좀은 센서 분자(PRRs), 어댑터 분자(ASC), pro-caspase로 구성된 복합체이며, 센서 단백의 종류에 따라 여러 아형의 인플라마좀이 존재한다. 그 중에서도 센서 단백에 NLRs 도메인을 갖는 NLRP3 인플라마좀의 작용이 널리 알려져 있다. NLRP3 인플라마좀은 일반적으로 두 단계를 거쳐 활성화된다(그림 1). 세포가 병원체에서 유래한 PAMPs (주로 LPS와 같은 세포막 성분) 또는 염증성 사이토카인에 노출되면 세포 표면의 수용체가 이를 인지하고 순차적으로 세포 내에서 NF-κB 신호 경로가 활성화된다. 그 결과로 NLRP3, pro-IL-1β, pro-IL-18 등의 발현이 증가한다(개시 단계, signal 1). 다양한 내인성 DAMPs의 자극은 NLRP3/NEK7, ASC, pro-caspase-1로 구성되는 인플라마좀 복합체의 형성과 올리고머화(oligomerization)를 촉진하여 pro-caspase-1을 활성형인 caspase-1으로 전환한다(활성 단계, signal 2). 이러한 반응은 개시 단계에서 증가되어 있는 pro-IL-1β, pro-IL-18 단백을 절단하고 세포 밖으로의 분비를 가능하게 한다. 이때 함께 활성화되는 gasdermin D (GSDMD) 단백은 세포 내 물질을 외부로 방출하는 통로로 작용한다. 결과적으로 NLRP3 인플라마좀의 활성화는 염증성 사이토카인 분비와 pyroptosis에 의한 세포 사멸을 통하여 염증반응을 유도한다(그림 1).
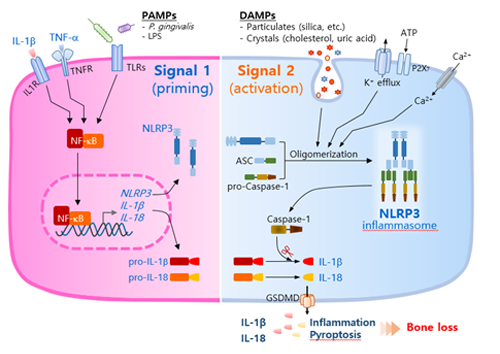
그림 1. 염증 반응에서 NLRP3 인플라마좀의 개시 및 활성화 과정.
골조직은 뼈 형성을 촉진하는 골모세포와 뼈 흡수를 야기하는 파골세포에 의해 정교하게 조절되고 있다. 또한 골조직 내에 존재하는 대식세포, 단핵구, 호중구 및 Th17 세포 등과 같은 면역세포도 골모세포 및 파골세포와 신호를 교환하며 골조직 항상성 조절에 관여한다. 이러한 뼈의 구성 세포들에서도 NLRP3 인플라마좀 신호 경로가 존재하며, 그 활성 증가는 IL-1β, IL-18 분비 및 세포 사멸을 유도한다. 인플라마좀 매개 염증 반응은 골모세포 활성 억제 및 파골세포 활성의 증가를 유도하여 결과적으로 골량의 감소를 초래하는 것으로 생각된다. 인플라마좀 활성에 의한 골소실의 증거는 골질환이 있는 환자나 유전자 결핍 마우스를 포함한 다양한 조건의 실험에서 확인된다.
제대혈 중간엽줄기세포에 염증 유발 인자인 LPS를 처리하면 NLRP3 인플라마좀의 발현과 Caspase-1 활성 증가와 함께 골모세포의 분화가 감소하였다. 또 NLRP3 활성 증가로 생성되는 IL-1β는 파골세포의 활성을 촉진시켜 골 기질을 파괴하고 석회질 용해를 촉진하였다. 노화, 폐경, 관절염, 당뇨병 상황에서도 염증인자의 분비 증가와 함께 파골세포의 활성 증가가 관찰되며, NLRP3 유전자 결핍 마우스 및 인플라마좀 억제 약물 투여 마우스에서는 이러한 골소실이 감소하였다. Staphylococcus aureus에 의해 유도된 마우스 골수염 조직과 골수염 환자의 감염 골조직에서는 pyroptosis 관련 단백, NLRP3, Caspase-1, GSDMD 발현과 세포사멸이 증가되어 있으며, 치조골 소실을 동반하는 치주염 환자에서도 NLRP3 경로 활성 및 IL-1β 발현이 증가되어 있다.
치주염은 구강 내 특정 세균(P. gingivalis, A. Actinomycetemcomitans, T. forsythia, T. denticola 등)의 지속적 자극에 따른 면역 반응의 결과로 치아를 둘러싼 잇몸과 뼈가 파괴되는 염증성 질환이다. 코호트 분석 결과에 의하면, 치조골 소실은 당뇨병, 비만, 고지혈증, 류마티스 관절염 등 염증을 동반한 질환과 상관관계를 보인다. 따라서 염증이 매개하는 골소실의 연구에 치주염 동물 모델이 자주 사용된다.
마우스에서는 약 9개월 정도의 연령이 되면 자연적으로 치주염이 발병하며, 인간과 유사하게 연령이 증가할수록 더 많이 발병한다. 젊은 연령의 마우스에서는 1) 치아 주위 조직에 염증성 사이토카인(TNFα, IL-1β)이나 치주염 유발 세균을 직접 도포 또는 주사하거나, 2) 치아 주위로 봉합 실크를 감아주거나, 3) 트리니트로벤젠 설폰산(TNBS) 또는 덱스트란 설페이트 나트륨(DSS)을 경구 투여하면 염증 세포의 증가와 함께 치조골 소실이 관찰된다. 동물모델에서도 인간의 치주염에서와 같이 염증성 사이토카인 및 활성산소(ROS)의 변화를 관찰할 수 있으며, 방사선 미세단층촬영(μCT) 및 조직 분석을 통해 정량적인 골소실도 확인할 수 있다. 정량적 골소실은 주로 방사선 이미지에서 치아의 시멘트-에나멜 접합부(Cement-Enamel Junction)에서 치조골 상단부(Alveolar Bone Crest)까지의 거리로 평가한다(그림 2).
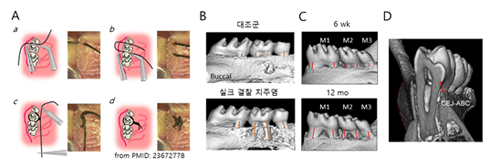
그림 2. 골소실을 동반하는 치주염 동물모델.
A. 치주염 유발을 위한 실크결찰 과정(PMID: 23672778).
B. 실크결찰에 의한 치조골 소실 분석(μCT).
C. 연령 증가에 따른 치조골 소실(μCT).
D. 골소실의 정량적 분석(μCT). CEJ, Cement-Enamel Junction. ABC, Alveolar Bone Crest.
본 연구실에서는 노화 및 실크 결찰을 통한 치조골 소실 동물모델에서 NLRP3 인플라마좀의 역할과 억제제 MCC950의 효능에 관한 연구를 수행하고 있다(그림 3). 12개월령 마우스에서는 6주령 마우스에 비해 치주인대공간의 증가와 치조골 소실이 관찰되었다. 또 연령 증가에 따라 치아와 치조골 사이 치주인대 조직에서 활성형 Caspase-1을 발현하는 대식세포와 파골세포의 수가 증가하였으며, 혈액 내 IL-1β의 양도 증가하였다. 이러한 변화는 NLRP3-/- 마우스와 NLRP3 억제제 MCC950 투여 마우스에서 감소하였다. 시험관 내 실험에서 IL-1β는 RANKL에 의한 파골세포 분화를 증가시켰으며, MCC950 투여는 활성형 Caspase-1의 감소와 함께 파골세포 분화를 억제하였다. 이러한 결과들은 세균 또는 대사질환 염증에 의한 골소실에 NLRP3/Caspase-1/IL-1β 경로가 중요하게 관여하며, 인플라마좀 경로의 억제가 염증에 의한 골소실의 치료적 표적이 될 수 있음을 의미한다.

그림 3. 노화에 따른 치조골 소실과 NLRP3 인플라마좀 억제제 MCC950의 효과
미생물 침입에 따른 염증 과정에서 숙주세포의 외부 유해 요소 인지와 인플라마좀 활성 및 염증성 사이토카인의 분비 기전이 밝혀지면서 염증 치료제 개발을 위한 연구가 활발히 진행되고 있다. 최근 당뇨병, 고지혈증, 관절염 등 만성 염증을 동반하는 질환에서 인플라마좀의 활성 증가와 골밀도의 감소가 확인되고 있으며, 다양한 질환 동물모델에서 NLRP3 활성 억제가 염증에 의한 골소실을 억제하였다. 골조직 구성 세포에서의 인플라마좀 활성 기전과 억제제 개발 및 다양한 동물모델에서의 효능 평가에 대한 심화 연구가 진행되어 새로운 골질환 치료제가 개발되어지길 기대해 본다.


Copyright(c) Korean Endocrine Society. All rights reserved.