연세대학교 의과대학 의생명과학부 세포에너지 다이내믹스 연구실
(Laboratory of Dynamics in Cellular Energetics)
황성순 (연세대학교 의생명과학부)
1. 연구실 개요
에너지의 공급과 소모는 생명체를 유지하는 근간이다. 모든 동물은 탄수화물, 지방, 단백질이라는 3종류의 에너지원을 기반으로 생명을 유지하고 있으며, 스스로 에너지원을 공급할 수 없기에 외부에서 획득한 에너지원을 흡수/소모함으로써 생명유지에 필요한 생체에너지를 만들고 있다. 따라서 동물, 특히 포유류를 기반으로 한 사람의 에너지 흐름을 이해하기 위해서 본 연구실은 1) 외부에서 공급되는 에너지를 세포 내로 흡수하는 과정, 2) 흡수된 에너지원이 생체에너지로 가공되어가는 과정, 3) 에너지원과 생리적 반응의 상호작용을 연구하고 있다.
2. 주요 연구 내용
1) Metabolic syndromes in response to nutritional stress
현대인의 대사질환 유병률은 계속 증가하고 있으며, 관련 질환에 대한 치료제 개발 요구는 계속 증가하고 있으나, 막상 임상에서 허가받은 대사질환 치료제는 의외로 많지 않은 상황이다. 특히 지방간 질환의 경우 아직까지 FDA 승인된 신약이 없는 가운데, 최근 Thyroid Receptor beta (TRβ) agonist로 알려진 Resmetirom 이 가장 앞선 단계에서 좋은 임상결과를 발표하며 주목을 받고 있다. Resmetirom 이전에 가장 앞서가던 타깃은 담즙산 핵수용체 Farnesoid X Receptor (FXR)로서 많은 세계적인 제약사가 FXR 기능을 활성화시키는 agonist 개발에 뛰어들었으나 임상3상에서 LDL 수치가 증가하거나 pruritus와 같은 부작용으로 인해 결국 FDA 승인을 획득하는데 실패하였다. FXR agonist가 실패한 가장 큰 원인으로는 FXR이 활성화되면 CYP7A1을 억제한다는 점이다. CYP7A1은 콜레스테롤을 분해하여 담즙산을 생성하는 효소인데, FXR이 활성화되면 담즙산 생성기전이 억제됨으로써 hepatic cholesterol 분해를 억제한다는 단점이 있다. 반면에 Resmetirom은 오히려 Thyroid Receptor beta를 활성화시켜 담즙산 생성기전을 증가시킬 수 있는 장점이 있는 것으로 보고되었다 (그림 1).
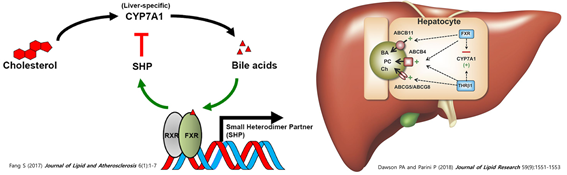 그림 1. Nuclear receptor FXR 과 TRβ가 제어하는 CYP7A1 expression. FXR이 활성화될 경우 CYP7A1 gene expression은 억제되지만, TRβ가 활성화될 경우 CYP7A1 gene expression이 증가한다.
그림 1. Nuclear receptor FXR 과 TRβ가 제어하는 CYP7A1 expression. FXR이 활성화될 경우 CYP7A1 gene expression은 억제되지만, TRβ가 활성화될 경우 CYP7A1 gene expression이 증가한다.
이와 같은 핵수용체 FXR, TRβ는 담즙산 및 thyroid에 반응하여 다양한 생리적 기능을 담당하고 있다. 담즙산 및 thyroid는 콜레스테롤 혹은 아민을 전구체로 생성되는 호르몬이기에 우리 몸에 흡수되는 다양한 에너지원이 신호전달물질로 작용할 수 있다.
따라서 본 연구실은 흡수된 에너지원에 따라 신호전달물질의 구성 변화 및 세포 내 신호전달 체계의 변화를 연구하는 것을 우선적인 목표로 하고 있으며, 이를 장-간축 신호 회로를 중심으로 지방간 질환을 비롯한 인슐린 저항성 등의 대사성질환의 치료 전략 및 새로운 치료 타깃 발굴을 중점적으로 연구하고 있다.
2) Cancer cell energy metabolism in response to nutritional stress
암은 아직까지 정복하기 어려운 만성질환이며 1세대 화학항암제, 2세대 표적항암제, 그리고 3세대 면역항암제 개발이 완료되어 다양한 암종에서 치료제로 사용되고 있다. 그러나 3세대 면역항암제 역시 반응률이 20%대로 매우 낮으며, 표적항암제의 저항성은 여전히 극복하기 어려운 상황이기에, 새로운 치료 전략 개발이 필요하다. 이를 위해 최근 암세포에서 독특하게 나타나는 에너지대사기전을 연구하여, 암세포의 에너지대사 과정에서 특이하게 나타나는 분자기전을 발굴하고, 이를 항암제의 저항성 기전과 연결하여 항암제의 반응률을 증가시키는 연구가 활발히 진행 중이다.
PHGDH는 glucose 혹은 glutamine 등과 같은 다양한 에너지원을 활용하여 세린을 만들 수 있도록 유도하는 효소로서, 세린은 단일탄소대사기전을 거쳐 NADH/NADPH를 합성하여 glutathione을 생성하거나, 메틸기를 생성하여 후성유전체를 제어할 수 있고, nucleotide를 생성할 수 있도록 유도한다 (그림 2).
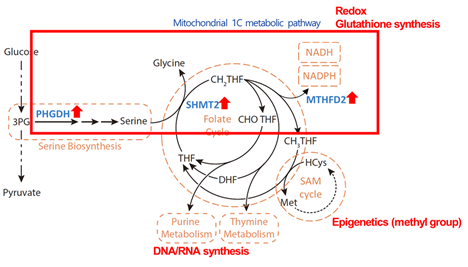 그림 2. PHGDH에 의해 합성된 세린이 사용되어가는 과정. 단일탄소대사기전을 통해 Glutathione 합성, 메틸기 합성, 뉴클레오타이드 합성에 사용된다.
그림 2. PHGDH에 의해 합성된 세린이 사용되어가는 과정. 단일탄소대사기전을 통해 Glutathione 합성, 메틸기 합성, 뉴클레오타이드 합성에 사용된다.
한국인에게서 발병률이 매우 높은 위암의 경우, Stem-like EMT (SEM) type으로 알려진 위암 타입은 항암제에 대한 저항성이 매우 크고 현재 치료할 방법이 없는 상황이다. 본 연구실은 최근 serine biosynthesis에서 가장 중요한 key enzyme으로 알려진 Phosphoglycerate dehydrogenase (PHGDH)가 항암효과에 대한 저항성을 유도할 수 있음을 확인하였다. SEM type 위암은 nutritional stress 혹은 항암제가 투여될 경우 PHGDH 및 mitochondrial 단일탄소대사기전을 활용하여 NADPH를 생성하고 glutathione을 합성함으로써 Redox balance를 증가시켜 environmental stress에 대한 저항성을 올리는 것을 확인하였다. 특히 SEM 타입의 위암 세포들은 크로마틴 구조 자체가 Redox balance를 증가시키는 유전자 위주로 열려있음을 확인할 수 있었다 (그림 3).
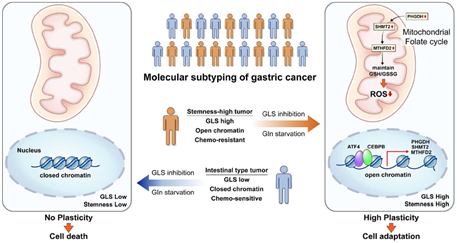 그림 3. 항암제 감수성이 좋은 장형 타입 위암 세포는 glutamine 등의 에너지원이 부족할 경우 사멸하지만, 항암제 저항성을 갖고 있는 SEM 위암 세포는 PHGDH를 이용한 mitochondrial folate cycle을 활용하여 살아남을 수 있다 (Yoon BK et al., PNAS 2023).
그림 3. 항암제 감수성이 좋은 장형 타입 위암 세포는 glutamine 등의 에너지원이 부족할 경우 사멸하지만, 항암제 저항성을 갖고 있는 SEM 위암 세포는 PHGDH를 이용한 mitochondrial folate cycle을 활용하여 살아남을 수 있다 (Yoon BK et al., PNAS 2023).
특히 이와 같은 분자기전은 단지 위암뿐만 아니라 난치성 암으로 잘 알려진 Anaplastic Thyroid Cancer (ATC)에서 Papillary Thyroid Carcinoma (PTC)에 비하여 단일탄소대사기전이 매우 증가되어 있음을 확인하였다. ATC 세포들은 SEM 타입 위암과 마찬가지로 nutritional stress에 대한 저항성이 매우 강하였으며, 특히 PHGDH 하위기전을 억제할 경우, 항암제에 대해 저항성을 갖고 있는 ATC 세포들의 항암제 감수성이 증가하는 것을 확인할 수 있었다 (그림 4).
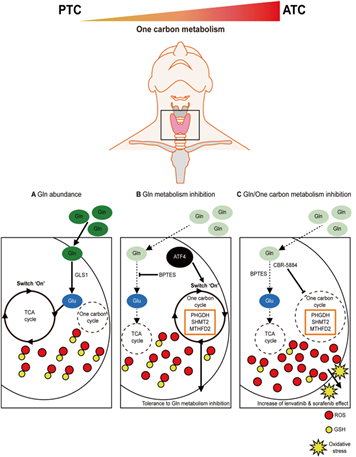 그림 4. PTC에 비하여 ATC의 경우 단일탄소대사기전이 증가해있음을 확인하였으며, 글루타민 등의 에너지원이 결핍되었을 경우에는 단일탄소대사기전이 활성화되면서 Redox balance를 증가시켜 살아남을 수 있다 (Hwang Y et al., Cell Death and Disease 2023).
그림 4. PTC에 비하여 ATC의 경우 단일탄소대사기전이 증가해있음을 확인하였으며, 글루타민 등의 에너지원이 결핍되었을 경우에는 단일탄소대사기전이 활성화되면서 Redox balance를 증가시켜 살아남을 수 있다 (Hwang Y et al., Cell Death and Disease 2023).
3. 맺음말
현재 PHGDH를 기반으로 세린이 합성된 후 단일탄소대사기전에서 활용되는 분자기전은 Redox balance, 후성유전체, nucleotide 합성을 담당하고 있다. 이 분자기전은 nutritional stress 등에 반응하는 분자기전임을 확인했으며, 항암제에 대한 저항성 뿐만 아니라, 다양한 대사성질환에서도 새로운 치료 전략으로 각광받을 것으로 기대한다. 특히 단일탄소대사기전에 의해 Redox balance가 증가하기에 PHGDH를 비롯한 단일탄소대사기전의 주요 효소들을 활성화시킬 수 있는 물질을 개발한다면 Redox balance를 회복함으로써 대사성질환에서 일반적으로 나타나는 Oxidative stress를 억제하여 insulin resistance 및 tissue inflammation 등을 제어하여 증상을 완화시킬 수 있을 것으로 보인다. 반면에 항암효과를 유도하기 위해서는 PHGDH 및 단일탄소대사기전의 주요 효소를 억제하는 물질을 활용하여 새로운 항암제를 개발할 수 있을 것으로 기대한다.
 2023 세포에너지 다이내믹스 연구실 (ICKSMCB 2023)
2023 세포에너지 다이내믹스 연구실 (ICKSMCB 2023)
연구실 홈페이지: https://sites.google.com/view/fang-lab
4. 참고문헌