연구실 소개
본 암 미세환경 대사 연구실(Tumor Microenvironment and Metabolism Lab)은 POSTECH에 2023년 막 문을 연 신생 연구실로, 암세포가 생존을 위해 사용하는 필수 대사 방식을 활용한 암 치료를 목표로 연구 중이다.
암은 왜 다르게 대사 하는가 (Metabolic rewiring in Cancer)?
세포는 지속적인 대사활동을 통해 세포 수준에서 처리되는 모든 생물학적 활동에 필요한 물질 (Biomolecule)과 에너지 원을 만든다. 하지만 모든 세포가 같은 방식으로 대사를 수행하는 것은 아니다.
지속적인 대사활동을 위해 세포는 환경으로부터 영양소를 섭취해 대사기전을 작동하는데, 흥미로운 점은 조직 혹은 세포들이 자신의 특화된 기능(tissue- or cell type-specific functions) 수행에 적합한 영양소를 선택적으로 사용하고(fuel preference), 특정 대사기전을 선택적으로 활성화함으로써(metabolic preference), 가장 효율적인 대사방식으로 세포 기능을 유지한다는 것이다.
이러한 관점에서 볼 때 세포성장분열(proliferation)에 극단적으로 특화된 암 세포가 정상세포와 다른 대사적 행동을 취하는 것은 놀랍지 않은 현상일 것이다.
실제로 1920년대 Dr. Otto Warburg에 의해 암 조직의 비정상적 대사 현상(Warburg effect: 산소가 있는 조건에서도 glucose를 이용해 ‘TCA-OXPHOS를 통한 ATP 생성’ 보다 ‘lactate 생성’을 선호하는 현상)이 관찰된 이후, 대사체 질량분석기술(mass spectrometry) 및 세포배양기술의 발전에 기반해 활발한 암 대사기전 연구들이 수행되어왔고, 암 세포가 빠른 속도의 세포성장분열을 위해 반드시 수행해야 하는 필수 대사활동(성장 및 생존을 위한 필수 영양소 및 필수 대사기전에 대한 대사 요구성 충족)에 대한 방대한 지식을 확보하였다.
이러한 지식의 축적은 자연스럽게 암 세포의 필수 대사기전을 활용한 항암치료제 개발시도로 이어졌고, 현재 많은 대사효소 억제제 및 대사 유사체(metabolic analogues)들이 전임상·임상단계에서 검증을 받고 있다.
암 대사 활용한 항암치료?
암 대사 표적 치료제 개발은 암의 성장 및 생존에 기반이 되는 대사기전을 활용한다는 점에서 새로운 항암치료의 활로를 제시하였지만, 전임상·임상단계에서 많은 후보 치료물질들이 퇴출되면서 다음과 같은 주요 한계점들이 현재 학계에서 활발히 논의되고 있다.
- 대사적 가소성(metabolic plasticity): 필수 대사기전억제를 연결된 다른 대사기전으로 회피.
- 정상조직 독성 (toxicity): 필수 대사기전억제가 정상조직의 대사에도 영향을 미쳐 독성 발현.
- 대사적 가용성 (metabolic availability): 세포 배양 조건에서 확보한 필수 대사기전이 실제 개체 내 (in vivo) 환경에서 특정 영양소 결핍 등의 조성 차이로 재현되지 않음.
- 암 조직 내 세포 종간 경쟁/협력 공생: 암 세포-정상 세포(immune cells, stellate cells, neuron cells 등) 간 대사적 경쟁 및 협력으로 필수 대사기전억제 효능저하.
이와 같은 주요 한계점들을 극복하고, 암 세포의 대사방식을 활용한 항암치료를 성공시키기 위해서는 ‘생체 내에서 재현성 높은’, ‘암 세포 특이적인’, ‘대체되기 어려운’ 필수 대사기전을 확보하여 표적하여야 한다.
이를 위한 학계에 다양한 최신 연구 방향 중, 필자는 암 미세환경의 대사 조성에 집중하고 있다.
미세환경의 대사조성이 암 대사 기전을 결정 할까?
암 미세환경의 대사 조성에 대한 이해는 암 세포의 in vivo 재현성 높은 필수대사기전을 찾는 열쇠가 될 수 있다.
암 조직은 매우 낮은 혈관분포(hypovascularity)에 의해 대사체의 혈관-조직 간 교환속도가 극도로 제한되어 있어, 영양소의 조성이 매우 독특하게 유지된다.
이같이 미세환경 내 척박한 대사조성에도 불구하고 암 세포는 대사적 변화를 통해 대사환경에 적응하여 생존·성장한다.
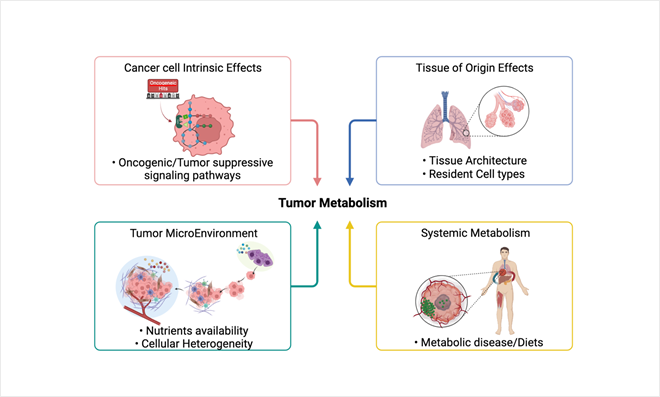
그림 1. 암 대사방식에 영향을 주는 주요 인자들
환경적 요소들은 암 미세환경의 대사조성 변화를 통해 암 세포에 영향.
암세포의 생존을 위한 대사적 변화를 가능하게 하는 핵심 인자(driver)는 유전자 변이에 의한 세포신호전달 변화(oncogeneic/tumor suppressive signaling pathways)를 통한 대사 기전의 조절로 이해되어 왔다.
하지만 앞서 논의되었듯 이러한 대사기전 변화들이 실제 환경에선 상당수 재현되지 않는데, 이는 암 미세환경의 독특한 영양소 조성에 기인한다.
유전자 변이가 변화시킨 광범위한 대사기전 중 실제 대사환경에 적합한 기전, 사용 가능한 영양소 대사기전 만이 선택적으로 활용되는 것이다.
환경의 영양소 조성이 암세포의 대사적 변화에 중요한 이유이다.
이와 더불어 암세포 대사방식에 변화를 주는 주요 인자들은– 1) 암이 생기는 본래 조직의 특성 (tissue of origin), 2) 개체 수준 대사 (Systemic metabolism) 및 식이 (diet), 3) 암 조직 내 공존하는 다양한 세포 종–궁극적으로 암 미세환경의 대사체 조성을 변화시킴으로써 암 세포 대사기전에 영향을 미친다.
이와 같이 암 미세환경의 대사조성은 암세포가 반드시 적응해야 하는 환경요인(pressure)이자 암 세포가 변화시켜 실제로 활용하는 대사기전의 중요한 결정요인(determinant)이라고 생각 할 수 있을 것이다.
연구 주제
본 연구실에서는 고형 암 종들의 미세환경 대사체 분석 및 암세포 대사기전 활성 분석을 기반으로 개체 내에서 재현성 높고, 암세포 특이적이며, 성장·생존에 필수적인 대사기전 발굴 및 이를 활용한 치료제 개발을 목표로 다음과 같은 학계의 최신 핵심 난제들을 해결하고자 연구를 수행 중이다.
-
암 세포는 무엇을 먹고 사는가? – 미세환경 영양소 조성 분석 및 암 종간 비교 연구
환경에 결핍된 필수 영양소는 암세포가 생존·성장을 위해 해결해야 할 숙제다. 암 미세환경에 조성되는 필수 영양소의 정량적 연구로, 암 세포가 필수 영양소 중 어떤 것을 쉽게 환경으로부터 얻을 수 있고, 얻을 수 없는지 이해할 수 있다. 이를 기반으로 실제 개체 내에서 사용되는 필수 대사기전을 발굴할 수 있을 것이다. 본 연구실에서는 암 조직의 세포간질액(tumor interstitial fluids) 동정 및 In vivo metabolic tracing의 기술들을 이용하여 암 세포가 개체 내에서 어떤 영양소를 사용하는지, 어떤 영양소 결핍에 적응해야 하는지, 어떤 대사기전의 변화를 통해 적응하는지 연구 중이다.
-
암 세포는 어떻게 대사환경에 적응하는가? – 필수영양소 결핍에 적응하기위한 후생학적 변화 연구
최근 다양한 연구를 통해 대사환경에 대처하는 세포의 적응 과정에 광범위한 후생학적 변화(global epigenetic changes)가 수반되는 것이 보고되고 있다. 이는 후생학적 조절에 시작인 히스톤 단백질의 modification (acetylation, methylation 등)에 대사체가 이용된다는 점에서 기인하는데, 특정 영양소의 결핍이나 세포 내 대사체 농도(acetyl-, methyl-donor) 변화에 따라 이와 같은 후생학적 modification의 패턴이 변화되는 것으로 이해하고 있다. 본 연구실은 암 세포가 생존을 위해 어떤 후생학적 변화와 후생학적 기억(epigenetic marks)을 통해 미세환경의 척박한 대사환경에 적응하는지 연구 중이다.
-
암 세포와 정상세포는 어떻게 대사적으로 공존하는가? – 미세환경 내 영양소 경쟁 및 협력 방식 연구
암 조직 내에서 암 세포와 정상 세포는 공존(symbiosis)한다. 대사적으로 고립된 암 미세환경 내에서 일어나는 세포 간 영양소 경쟁방식은 암 대사 분야의 오랜 질문이자, 항암 치료의 새로운 대안이 될 수 있는 주요 연구 주제이다. 최근 다양한 실험적 시도로 암 세포와 면역세포가 특정 필수 영양소 결핍을 두고 서로 다르게 적응하는 것이 알려지기 시작하였고, 암 세포가 성장을 위해 필요한 (그러나 환경에서 쉽게 구할 수 없는) 대사체를 주변 성상(stellate), 신경(neuron) 세포로부터 획득하는 대사적 협력이 보고되어, 암 세포–정상 세포 간 대사고리를 활용한 항암치료개발에 많은 관심이 집중되고 있다. 본 연구실은 암 미세환경 대사조성에 적응하는 암 세포와 정상세포의 대사기전을 연구하고, 이를 활용한 항암 치료하는 기술을 개발 중이다.
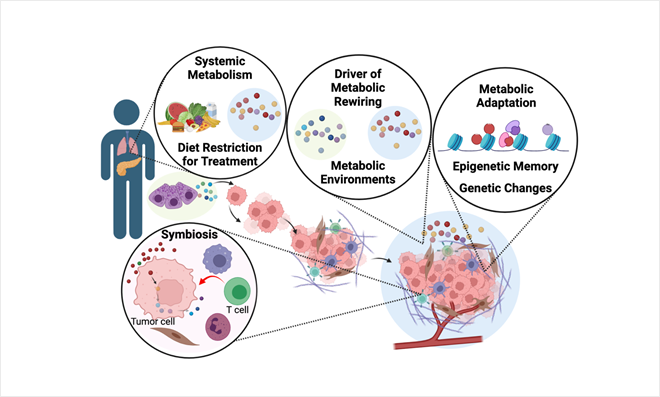
그림 2. 연구실 핵심 연구 주제:
미세환경 영양소 조성에 적응하는 암 대사방식 연구 및 조절을 통한 항암 치료개발.
연구실의 플랫폼 및 최신동향
미세 환경의 대사 분석을 통한 암 대사 연구에 기반이 되는 최신 플랫폼과 학계에 논의되는 최신 기술.
-
미세환경 대사 연구
세포 배양을 넘어 암 미세환경에서 대사를 연구하려는 노력은 진행중이다. 그간 기술적 한계로 미세환경의 대사체 조성을 연구하는 것이 어려웠고, 대안적 방법으로 필수영양소의 농도를 혈액 수준으로 맞춘 혈액환경모사 배지를 사용하는 시도가 있었다. 보다 최근엔 필자와 더불어 몇 그룹에서 암 조직 내부, 세포 밖 공간을 채우고 있는 세포간질액을 추출하여 대사체를 정량하는 연구를 통해 미세환경의 대사체 분석이 가능함을 보고하였다. 하지만, 세포간질액도 전체 암 조직에서 추출되어, 조직의 주변부(비교적 혈관과 가까운)와 중앙부(가장 혈관으로부터 고립되어 있는)의 공간적 정보를 얻지 못하는 한계가 존재한다.
-
대사체의 공간적 정보 (spatial metabolomics)
암 조직 내 대사체 농도의 공간적 정보는 중요하다. 최근 imaging mass spectrometry(MALDI: Matrix-assisted laser desorption/ionization mass spectrometry)가 빠르게 적용되어, 암 조직에서 특정 대사체의 농도 분포를 정량 및 이미지화 할 수 있게 되었다. 하지만, 세포 내 대사체의 정량만 가능하고, 이미지화 되는 대사체의 정략적 정보는 대사기전의 활성도(metabolic flux, 대사체의 합성속도 및 분해속도)를 반영하지 못하는 한계가 존재한다.
-
In vivo 대사 연구
개체 내에서, 보다 환자에 가까운 환경에서 대사를 연구하려는 학계의 논의도 활발히 진행 중이다.
a. In vivo metabolic tracing study: 본 연구실과 더불어, 최근 대사 분야에서 수행되는 in vivo tracing study는 살아있는 동물 혹은 나아가 환자의 정맥에 안정질량동위원소 (stable heavy isotope)을 일정시간 동안 투여한 후, 질량분석을 통해 표지된 대사기전을 관찰하는 실험으로, in vivo 대사기전의 활성도 관찰 가능.
b. 미세환경 모사배지: 세포간질액을 통해 암 미세환경의 광범위한 대사체 정량이 가능해지면서, 미세환경을 모사한 배지를 사용한 세포배양 및 대사 연구가 제시되고 있음.
c. 생 조직 배양: 동물 모델의 한계를 극복하기 위한 시도도 논의 중이다. 한 가지 대안으로 암 환자의 생 조직을 짧은 시간동안 ex vivo배양하면서, 대사활성을 연구하고, 항암효과를 검증하는 것이 보조적 모델로 제안되고 있다.
본 연구실도 이미 갖고 있는 최신 플랫폼과 위에 언급된 한계를 극복하는 새로운 기술을 개발하는데 많은 노력을 쏟고 있다.
맺음말
근대 암 연구의 한 중추로 자리잡은 암 대사는 필수 대사의 억제가 보여주는 강력한 암 살상효과와 더불어 암 종별, 환자 개인별, 암 내 암세포 별로 매우 상이한 유전적 변화와 달리 암 세포가 사용하는 필수영양소의 수는 매우 제한적이라는 점에서 보다 광범위하고 효과적인 항암 치료의 표적이 될 수 있다. 학계에서 진행 중인 다양한 노력으로 기존 연구의 한계를 넘어 암이 살아가는 환경의 실제 대사를 관찰할 날이 멀지 않았고, 그로부터 확보해 나갈 항암 치료법들을 그리며 글을 마치고자 한다. 끝으로 본 연구실의 연구 내용과 기술, 관련 최신동향을 소개할 수 있도록 기회를 주신 대한내분비학회 관계자 여러분들께 감사의 말씀을 드린다.
참고문헌
- Faubert, B., Solmonson, A. & DeBerardinis, R. J. Metabolic reprogramming and cancer progression. Science 368, doi:10.1126/science.aaw5473 (2020).
- Dey, P., Kimmelman, A. C. & DePinho, R. A. Metabolic Codependencies in the Tumor Microenvironment. Cancer Discov 11, 1067-1081, doi:10.1158/2159-8290.CD-20-1211 (2021).
- Muir, A., Danai, L. V. & Vander Heiden, M. G. Microenvironmental regulation of cancer cell metabolism: implications for experimental design and translational studies. Dis Model Mech 11, doi:10.1242/dmm.035758 (2018).
- Pavlova, N. N., Zhu, J. & Thompson, C. B. The hallmarks of cancer metabolism: Still emerging. Cell Metab 34, 355-377, doi:10.1016/j.cmet.2022.01.007 (2022).
- Graphic figures in this article were created in BioRender




 그림 1. 암 대사방식에 영향을 주는 주요 인자들
그림 1. 암 대사방식에 영향을 주는 주요 인자들 그림 2. 연구실 핵심 연구 주제:
그림 2. 연구실 핵심 연구 주제: