



미토콘드리아 지방대사에 따른 골격근의 생리적 기능과 대사질환 개선 연구
윤혜진 (울산과학기술원(UNIST) 생명과학과)
1. 세포 에너지 대사 연구실 소개
본 연구실은 울산과학기술원 생명과학과에 소속되어 있으며, 대사질환에서 미토콘드리아의 기능과 분자 기전에 대한 연구를 하고 있다. 특히, prolyl hydroxylase domain 3 (PHD3, EGLN3) 와 같은 스트레스 감지 효소들이 mitochondrial fuel utilization, bioenergetic와 signaling에 미치는 영향을 분자생물학적, 생화학적 그리고 대사프로파일링 분석방식으로 접근하고 있다. 골격근과 같이 미토콘드리아의 기능이 에너지 대사 조절에 결정적인 대사 장기들 뿐 아니라, 백혈병 모델을 통해 에너지 대사조절이 암에 미치는 영향을 세포 및 유전자 변형 마우스와 질환 동물 모델을 활용하여 연구를 수행 중이다. 상기 연구를 통해, 대사 질환에 대한 골격근의 생리 생화학적 이해를 넓히고, 나아가 대사산물인 대사체를 미래지향적 새로운 치료 전략으로 제시하고자 한다.
2. 지질 독성 (lipid toxicity)
세포 지질은 수만 가지의 지질 종을 만들 수 있는 개별 분자 구성 요소의 다양한 집합을 포함하고 있으며, 이를 총칭하여 lipidome이라고 한다 (PMID: 19408941). 지질 대사는 세포막 합성 및 에너지 저장소로서의 지질 (triglycerides; TG)의 사용을 포함하여 항상성에 중요한 많은 세포 과정에 영향을 미친다. 지방산(fatty acid, FA)은 막 지질 (glycerophospholipids; GPLs, and sphingolipids)의 주요 구조 성분을 구성하는 필수 지질이며, 미토콘드리아 매개 지방산 산화 (β-oxidation)및 tricarboxylic acid (TCA) cycle을 통한 에너지 생산에 중요하다. 순환 지질 (circulating lipid)의 과도한 양적인 변화는 대사 질환(PMID: 26892959, PMID: 30901535) 및 암 (PMID: 26807644) 과 관련이 있다. 이렇게 과도한 지질에 장기간 노출되어 세포가 받는 유해한 영향을 '지질 독성 (lipid toxicity)'이라고 하며 (PMID: 31628942, PMID: 24740729), 이 용어는 Roger Unger와 동료들이 췌장 β 세포의 기능 억제를 설명하기 위해 처음 사용되었다. 예를 들면, 세포 기능 및 지질이 과부하된 쥐의 pancreatic islet에서 제2형 당뇨병이 발병하는 것은 잘 알려져 있다 (PMID: 7971976). Lipid toxicity의 기본 분자 메커니즘에는 소포체(ER) 스트레스, 산화 스트레스, 미토콘드리아 기능 장애, 자가포식 장애 및 염증이 포함된다 (PMID: 31628942). 구체적으로, FA의 흡수 또는 합성과 소비 사이의 불균형이 있는 대사 장애에서 지질 중간체가 세포 내 축적되어 신장, 뇌, 골격근 및 심장을 비롯한 다양한 조직에서 세포 기능 장애 및 사망을 초래한다 (PMID: 22682221). Free FA (FFA)를 구조적 지질, lipid droplets (LD) 또는 β-oxidation을 위한 미토콘드리아로 효과적으로 전달하는 것은 지질 축적의 유해한 영향을 완화할 가능성이 있다. 이에 따라, (1) 흡수 또는 지질 합성과 지질의 대사가 하위 신호 전달 경로에 주는 영향, (2) 지질 중간체의 세포내 축적은 어떻게 세포 기능 장애에 직접적으로 기여하는지에 여부를 이해하는 것이 떠오르고 있는 대사질환에서의 lipid toxicity에 대한 중요한 질문들이다.
특히, 지금까지 지방은 비만의 중요한 표적인자로 알려져 있으며, TG, FFA, cholesterol등의 하위 대사체인 여러가지 지질종이 질환에 미치는 직접적인 역할을 질량분석기와 생화학적 기전연구를 통해서 알 수 있다. 지질 종은 대사 항상성을 유지하고, 필수 세포 기능을 방해하여 대사 장애를 유발한다. 다시 말하자면, 이 각각의 지방산은 세포에 유익하기도 하고, 독성을 가지기도 하지만 각각의 bioactive 지방산들의 생리 생화학적인 특징은 연구가 필요하다 (그림 1). Lipid toxicity가 만성 신장 질환, 지방간, 심부전, 비만, 신경 변성, 그리고 암 등에 미치는 기전은 지질 항상성과 질병 상태에서 FA 합성, 흡수, 분해 및 신호 전달을 통해 밝힐 수 있을 것이라 예상한다 (그림 1, PMID: 34547235).
흥미롭게도, 제2형 당뇨에서 골격근 조직의 비정상적인 지방 사용은 잘 알려져 있지만, 어떤 지질 종이 특정하게 조절되는지는 잘 연구되지 않았다. 본 연구실에서는 제 2형 당뇨를 유발하는 고지방 식이와 일반 식이 쥐 모델에서 골격근 (quadriceps, transverse abdominal (TA), extensor digitorum longus, gastrocnemius, soleus muscle)을 이용하여 어떤 지질 종이 특이적으로 증가 또는 감소하는지 대사체 및 지질체 분석 (lipidomics)방법을 구축 중이다. 생체 활성 지질 종은 normal chow와 비교하여 HFD 조건에서 골격근에서 서로 다르게 조절되는 예비 결과를 얻었다. 이를 기존 문헌들을 참고하여 lipid toxicity에 no effect, benign, toxic, 및 다중 불포화 지방산 그룹의 다양한 기능을 4 가지 범주로 분류하여, bioactive 지방산의 세포내 역할과 지방산의 각 조직내 수준을 연결하는 새로운 파이프라인을 구축하고 있다. 골격근에선 미토콘드리아 지방산 산화가 특징적이지만, 어떤 지방산이 가장 효율적으로 쓰이는 지도 알려져 있지 않다. 골격근 생물학에 어떤 지질 종이 독성 또는 유익한 지 이해하기 위해 생물학적으로 관련된 지방산을 기반으로 하는 지질학 라이브러리를 사용하여 high-throughput screening 분석이 진행중이다. 본 스크리닝을 통한 선별된 지방산은 지방대사 조절을 통해 제2형 당뇨와 비만뿐만 아니라 암성 악액질(Cancer Cachexia), 근위축증과 같은 다른 골격근 대사 질환에 대한 새로운 치료전략을 제시할 수 있다. 골격근뿐 아니라 다양한 대사 장기 모델에서 해당 파이프라인을 적용한다면, 지질 대사에 대한 더 나은 이해를 제공하고 다양한 가설을 개발 기회가 있을 것이라 기대된다.
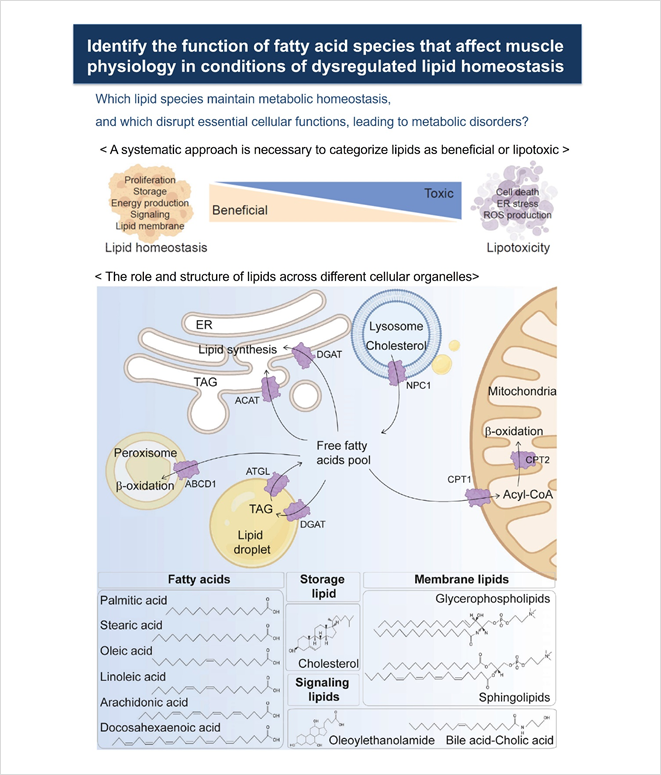
그림 1. Bioactive lipid species의 생물학적 기능 (PMID: 34547235)
3. 지방산과 대사 질환
FA 대사의 손상은 다양한 인간 질병에 중대한 결과를 초래한다 (그림 2, PMID: 34547235). CRISPR기반 유전자 스크린 및 lipidomics를 통해 FA가 막 및 storage glycerolipids에 통합되는 방식을 조절하는 효소를 연구하는 새로운 연구방법도 도입되었다. 조직의 지질 축적은 세포 기능 장애의 원인으로 인식되고 있다. 대부분의 대사 장기는 지질 부하를 처리할 수 없으며 과도한 지질이 세포 손상 또는 지방 독성을 유발하는 기전은 신장, 간, 심장, 골격근 등에서 많은 연구가 진행중이다. Saturated FA는 세포 사멸, 염증, ceramide, ROS, small nucleolar RNA (PMID: 21723502) 및 ER stress와 같은 다양한 해로운 세포 반응을 유발한다. 여기에서 우선순위는 지방독성 세포 반응을 조절하는 생리활성 지질 종을 지정하는 것이다.
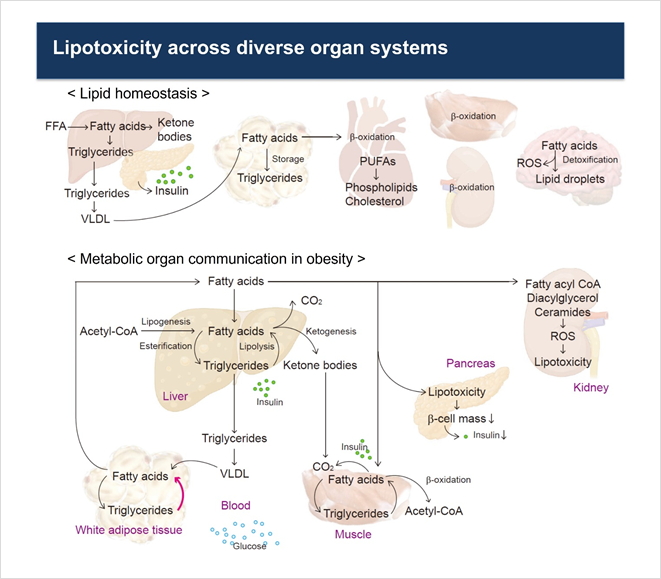
그림 2. Lipid homeostasis and disease (PMID: 34547235)
Adipose tissue는 에너지 항상성의 주요 조절자이며, 지방 조직의 조절 장애는 말초 조직의 부적절한 부하로 인해 에너지 항상성의 불균형을 초래한다. 지방세포는 에너지 저장을 위한 저장소 역할을 하지만 에너지 수요를 감지하고 주변분비 인자를 분비하여 다른 대사 조직을 조절한다. 특히, WAT의 주요 기능은 에너지 수요 기간 동안 nonesterified FA (NEFA)를 혈류로 방출하는 것이다. 최근, short-chain FA(SCFA) 및 TCA cycle metabolite WAT에서의 지방 생성에 직접적으로 관여한다는 연구가 있다 (PMID: 33712368). Acetate, butyrate, and propionate 포함한 SCFA는 지방분해를 억제하고, WAT에서 지방 생성을 촉진하고 포도당 및 지질 합성을 위한 기질을 제공한다 (PMID: 33712368). 지방 세포의 다양한 분화 단계에서 수행된 연구는 비만 및 제2형 당뇨병 기전에 대한 중요한 치료 전략을 제시할 수 있다.
FA는 WAT에서 TG의 지방분해 후 혈액을 통해 간으로 전달된다. 간에서 FA는 FABP1에 결합하고 미토콘드리아 β-oxidation에 의해 대사된다. 비알코올성 지방간 질환(NAFLD)의 주요 유전적 결정인자는 PNPLA3, HSD17B13 및 TM6SF2이며, 새로운 지방 생성 및 지방 이화 작용을 제어하는 경로의 조절 장애로 인해 간 지방증이 발생한다. 여러 지질 중 특히, PA hydroxystearic acid (PAHSA)은 anti-diabetic과 anti-inflammatory 효과가 있는 내인성 지질이다. 만성 PAHSA 치료는 간 인슐린 감수성을 높이고 지방 조직의 지방 분해를 억제하여, 고지방식이를 한 마우스의 골격근과 심장에서 insulin-stimulated glucose의 흡수를 증가시킨다 (PMID: 31449056). 또한 PAHSA는 GPR40 수용체를 매개하여 glucose tolerance 및 인슐린 감수성을 개선한다 (PMID: 29414687)
제2형 당뇨와 이를 유발하는 비만에서는 다른 대사에 관련된 조직 에서처럼, 골격근 조직에서 비정상적인 지방 사용이 특징적이다 (PMID: 27148161). 무엇보다 근세포는 미토콘드리아의 지방산의 산화가 가장 활발하게 일어나는 곳이다. 지질 대사의 중요성에도 불구하고, 제 2형 당뇨 또는 비만 모델에서 미토콘드리아 지방대사가 질병 진행에 기여하는 기전과 지방산 산화를 조절하는 상위 메커니즘은 밝혀져 있지 않다. 지방산 의존적인 대사 조절 경로를 밝히는 것은 새로운 치료 방법의 개발 또는 맞춤 치료에 대한 표적인자들을 발견하기 위해 절대적으로 필요하다.
본 연구실에서는 미토콘드리아 내 대사체의 양적인 변화와 미토콘드리아의 산화능력이 대사질환에 미치는 영향을 연구하였다. 특히, prolyl hydroxylase domain 3 (PHD3, EGLN3)가 미토콘드리아 지방산 산화 (fatty acid oxidation, FAO)의 조절자인 acetyl-CoA carboxylase (ACC2)를 수산화하여 지방산 대사를 억제하며, 근육에서 PHD3 결핍으로 인해 운동능력이 증가하는 것을 쥐 모델을 통해 확인했다 (PMID: 32663458, 그림 3). PHD3 손실은 골격근에서 지방산 산화를 촉진하며 운동 능력을 30% 증가시킨다 (PMID: 32663458). 이 PHD3 손실 쥐 모델을 이용하여 지방 대사 능력을 향상시킬 경우, 고지방 식단 (high fat diet, HFD)에서 체중 증가를 방지하고, 나아가 당뇨병 전 표현형이 개선되는 예비 결과를 얻었다. 본 연구에서는 제 2형 당뇨에 특이적으로 나타나는 지질 종을 선별하여 새로운 표적인자로 제시하는 것이 목표이다. 나아가 골격근의 생리학적 기능을 증가시켜 제 2형 당뇨를 치료할 수 있는 맞춤형 치료제를 개발하는 것을 목표로 한다.
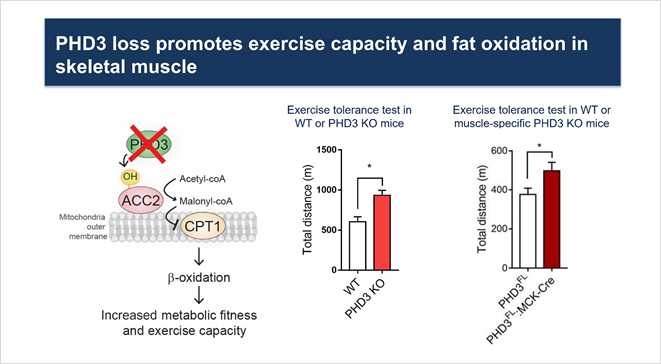
그림 3. PHD3 손실에 따른 골격근에서 지방산 산화를 증가와 운동능력 향상 (PMID: 32663458)
또한, 예비 연구 결과를 통해, 지방산 산화 촉진이 인슐린 민감성을 증가시키고, 고지방 식단에서 체중 증가를 방지하는 것을 확인했다. 기존에 연구에서 ceramide와 triacylglycerol은 인슐린 신호전달을 억제한다고 알려져 있다. Palmitate 와 같은 saturated fatty acid에서 합성되는 ceramide는 인슐린 신호 전달의 두 가지 주요 인자인 Akt와 IRS1을 표적으로 한다 (PMID: 24797432). 미토콘드리아 지방산 산화 촉진은ceramide와 triacylglycerol 합성을 저해하여 인슐린 신호를 촉진할 것이라 예상된다. 근육에서 PHD3를 결핍시킨 쥐 모델을 이용하여 지방산 산화를 촉진하여, 지질 항상성과 관련된 대사 산물을 변경함으로써, 근육의 인슐린 신호 전달을 향상시키는 연구를 진행중이다. 종합적으로, 골격근에서 지방 대사가 인슐린 감수성을 증가시키는 기전을 밝히고, 골격근의 기능변화가 비만에 미치는 역할을 생리학적으로 설명할 수 있다.
4. 맺는말
지방대사의 변화가 근육의 생리에 어떤 영향을 미치는지에 대한 기전연구는 더욱 연구가 필요하다. 특별히, 골격근은 지방산의 산화에 결정적인 대사 장기이다. 지방산 산화에 관계된 지방 대사가 골격근의 미토콘드리아의 미치는 영향, 근육세포의 분화에 대한 영향, type fiber에 대한 영향, 골격근의 양과 골격근 기능에는 직접적으로 미치는 영향 등의 향후 연구들은 골격근 생리에 대한 이해를 더욱 높일 수 있을 것이라 생각된다.
본 연구실에서는 대사질환과 골격근에서 지방산의 생물 물리적 특성을 병리학적 관점에서 이해하고자 한다. 특히, 지방의 하위 대사체인 여러가지 지질종이 대사질환의 진행에 직접적으로 영향을 미치는지 연구 중이다. 세부적으로는 미토콘드리아를 통한 지방 대사의 조절과 지방산 형성이 골격근의 인슐린 신호와 metabolic signaling를 조절하는 방법은 무엇인지를 이해하고자 한다. 이를 통해, 비만, 대사질환, 운동, 골격근 생리 등에서 가장 중요한 질문이었던 지방 대사에 대한 원천적인 기전연구를 통해 다각도의 치료방법 개발에 적용할 수 있을 것이라 기대한다.
5. 참고문헌
본문의 해당문장에 PMID(Pubmed ID)로 표기함.


Copyright(c) Korean Endocrine Society. All rights reserved.