



비만
김진택 (을지의대 노원을지대병원 내분비내과)
과체중 또는 비만 성인의 체중 감소 유지에 대한 지속적인 주간 피하 세마글루타이드 대 위약의 효과- STEP 4 무작위 임상 시험
Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or Obesity
Randomized Clinical Trial Domenica Rubino et al. JAMA. 2021;325(14):1414-1425
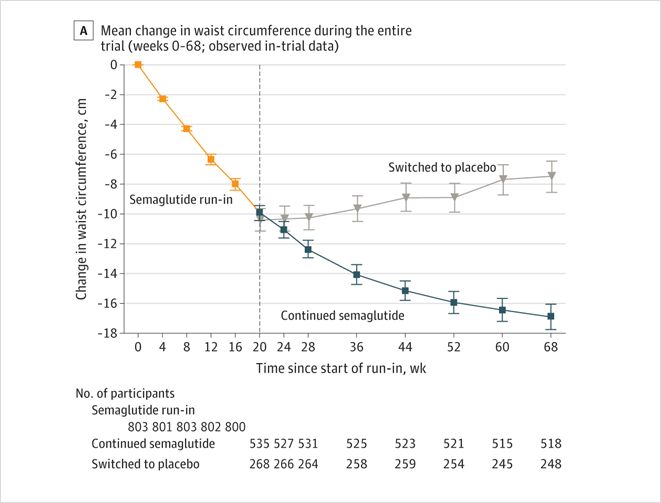
과체중 또는 비만인 사람의 체중 감소 유지에 대한 글루카곤 유사 펩타이드 1 GLP-1수용체 작용제인 세마글루타이드로의 치료 지속 또는 중단의 효과는 알려져 있지 않다. 과체중 또는 비만이 있는 성인의 체중 유지를 위해(두 그룹 모두 생활 방식 중재 포함) 피하 세마글루타이드 2.4mg으로 주 1회 지속적으로 투여하는 것과 매주 2.4mg 세마글루타이드를 20주간 투여한 후 위약으로 전환하는 것을 비교하였다. 2018년 6월부터 2020년 3월까지 10개국 73개 기관에서 체질량 지수가 30 kg/m2 이상(또는 체중 관련 동반질환이 1 이상인 경우 체질량 지수≥27 kg/m2) 성인을 대상으로 무작위, 이중 맹검, 68주 3a상 약물 중단 연구를 실시하였다. 총 902명의 참가자가 준비기간 동안 주 1회 피하 세마글루타이드를 투여하였다. 20주 후(용량 증량 16주, 유지 용량 4주), 세마글루타이드 유지 용량 2.4mg/wk에 도달한 803명의 참가자(89.0%)가 48주 연속 피하 세마글루타이드(n = 535) 또는 위약으로 전환(n = 268)하는 두 그룹으로 분류되었고 모두에서 라이프스타일 중재를 함께 시행하였다. 1차 종료점은 20주부터 68주까지의 체중 변화율이었다. 2차 종료점은 허리 둘레, 수축기 혈압 및 신체 기능(Short Form 36 Version 2 Health Survey, Acute Version [SF-36]을 사용하여 평가)의 변화였다. 20주 준비 기간(평균 10.6%의 체중 감소)을 완료하고 무작위 배정된 803명의 연구 참가자 중(평균 연령, 46[SD, 12]세, 634명[79%] 여성, 평균 체중, 107.2kg[SD, 22.7kg]), 참가자 787명(98.0%)이 시험을 완료했고 741명(92.3%)이 치료를 완료했다. 세마글루타이드를 계속 사용하는 경우 20주부터 68주까지의 평균 체중 변화는 -7.9% 대 위약으로 전환한 경우 +6.9%였다(차이, -14.8 [95% CI, -16.0 ~ -13.5]퍼센트 포인트; P < 0.001 ). 허리둘레(-9.7cm [95% CI, -10.9 ~ -8.5cm]), 수축기 혈압 (-3.9mmHg [95% CI, -5.8 ~ -2.0mmHg]), SF-36 신체 기능 점수 (2.5 [95% CI, 1.6 - 3.3])의 경우도 피하 세마글루타이드 지속으로 개선되었다(모두 P<0.001). 피하 세마글루타이드를 지속한 참가자의 49.1%에서 위장관 사건이 보고된 반면 위약에서는 26.1%가 보고되었다. 세마글루타이드(2.4%) 및 위약(2.2%)을 계속 사용했을 때 부작용으로 인해 유사한 비율이 치료를 중단했다. 과체중 또는 비만인 성인 중 20주간 피하 세마글루타이드(주 1회 2.4mg)를 투여한 후 위약으로 전환한 것과 비교하여 세마글루타이드로 치료를 유지한 결과 이후 48주 동안 체중이 계속 감소하였다.
일본 제2형 당뇨병 환자에서 둘라글루타이드와 비교한 터제파타이드 단일요법의 효능 및 안전성(SURPASS J-mono): 이중 맹검, 다기관, 무작위, 3상 시험
Efficacy and safety of tirzepatide monotherapy compared with dulaglutide in Japanese patients with type 2 diabetes (SURPASS J-mono): a double-blind, multicentre, randomised, phase 3 trial
Nobuya Inagaki et al. LANCET Diabetes & Endocrinology 2022; 10(9):623-633
질병이 진행됨에 따라 많은 제2형 당뇨병 환자는 치료 목표에 도달하는 데 어려움을 겪는다. 우리는 일본 제2형 당뇨병 환자에서 둘라글루타이드와 비교하여 새로운 GIP 및 GLP-1 수용체 작용제인 터제파타이드의 효능과 안전성을 평가하는 것을 목표로 했다. 이 다기관, 무작위, 이중 맹검, 병렬, 능동 제어, 3상 시험은 일본의 46개 의료 연구 센터 및 병원에서 수행되었다. 경구용 당뇨약제 단독요법을 중단했거나 치료 경험이 없는 2형 당뇨병이 있는 20세 이상의 성인이 포함되었다. 참가자들은 대화형 웹 응답 시스템(Interactive Web Response System)과 함께 컴퓨터에서 생성된 무작위 순서를 사용하여 일주일에 한 번 터제파타이드(5, 10 또는 15mg) 또는 둘라글루타이드(0.75mg)를 투여하도록 무작위로 배정(1:1:1:1)되었다. 참가자들은 기준선 HbA1c(≤8.5% 또는 >8.5%), 기준선 BMI(<25 또는 ≥25kg/m2) 및 당뇨약물의 휴약을 기준으로 계층화되었다. 참가자, 조사자 및 스폰서는 치료 할당에 가려졌다. 터제파타이드의 시작 용량은 4주 동안 주 1회 2.5 mg이었고, 이후 터제파타이드 5mg 치료군에서 5mg으로 증량하였다. 터제파타이드 10mg 및 15mg 치료 그룹의 경우 할당된 용량에 도달할 때까지 매 4주마다 2.5mg씩 증가하였다. 1차 종점은 수정된 치료 의도 모집단에서 측정된 52주차 기준선 대비 HbA1c의 평균 변화였다. 이 시험은 ClinicalTrials.gov, NCT03861052에 등록되어 있다. 2019년 5월 7일부터 2021년 3월 31일 사이에 821명의 참가자가 연구 자격에 대해 평가되었고 636명이 티르제파티드 5 mg(n=159), 10 mg(n=158) 또는 15 mg(n=160), 또는 둘라글루타이드 0.75mg(n=159) 투여군으로 무작위 배정되었다. 615명(97%)의 참가자가 연구를 완료했고 21명(3%)이 중단했다. 참가자의 평균 연령은 56.6세(SD 10.3)였으며 대부분 남성이었다(481[76%]). 52주차에 HbA1c는 기준선에서 터제파타이드 5mg의 경우 -2.4(SE 0.1), 터제파타이드 10mg의 경우 -2.6(0.1), 터제파타이드 15mg의 경우 -2.8(0.1), 둘라글루타이드의 경우 -1.3(0.1) 최소 제곱 평균만큼 감소했다. 둘라글루타이드에 비교한 예상 평균 치료 차이는 터제파타이드 5mg의 경우 -1.1(95% CI -1.3 ~ -0.9), 터제파타이드 10mg의 경우 -1.3(-1.5 ~ -1.1), 및 티르제파티드 15mg의 경우 -1.5(-1.71 ~ -1.4)(모두 p<0.0001)였다. 터제파타이드는 5mg의 경우 기저치에 비하여 체중이 −5.8 kg (SE 0.4; −7.8% 감소), 10mg의 경우 -8.5kg(0.4; - 10mg의 경우 11.0% 감소), 15mg의 경우 -10.7kg(0.4; -13.9% 감소) 감소하였고, 둘라글루타이드 그룹에서는 -0.5kg(0.4; -0.7%) 감소) 감소하였다. 가장 흔한 치료 관련 부작용은 메스꺼움(5 mg 그룹 19명(12%) vs 10mg 그룹 31명(20%), 15mg 그룹 32명(20%), 모든 터제파타이드 투여군 12명(둘라글루타이드 투여군에서 8%), 변비(24[15%] vs 28[18%] vs 22[14%] vs 17[11%]), 비인두염(29[18%] vs 25[16%])] vs 22[14%] vs 26[16%])이었다. 가장 빈번한 이상반응은 위장관계 부작용이였다(636건 중 23건[4%]). 터제파타이드는 혈당 조절 및 체중 감소에 대해 둘라글루타이드에 비해 우수하였다. 터제파파타이드의 안전성 프로파일은 GLP-1 수용체 작용제의 안전성 프로파일과 일치하여 일본 제2형 당뇨병 환자에 대한 잠재적인 치료 용도를 보여주었다.
