



영양분 감지 핵수용체를 통한 새로운 내분비 신호 전달 경로 발굴 연구
이재만(경북의대 생화학세포생물학교실)
본 연구실은 경북대학교 의과대학 생화학세포생물학교실에 소속되어 있으며, 영문 연구실 명은 Nuclear Receptor & Disease Laboratory (NRDL)를 사용하고 있다. 본 연구실에서는 분자세포생물학, 생화학, 유전학, 내분비학 및 오믹스학을 기반으로 다양한 실험 기법을 활용한 다학제 (multidisciplinary) 연구실을 추구하고 있다. 주요 연구 목표는 정상과 병태 조직에서 발현되는 영양분 감지 핵수용체(nutrient-sensing nuclear receptor)의 전사 조절 기전을 세포와 분자수준에서 이해하고, 더 나아가 이들 핵수용체의 새로운 표적유전자를 발굴함으로써 암, 염증 및 대사질환의 치료제 개발에 기여할 수 있는 원리 증명(proof of principle)을 구현하고자 한다
핵수용체는 리간드 의존적 전사인자(transcription factor, TF)로 인간 유전체에는 48개의 관련 유전자가 존재한다. 이들 핵수용체에는 스테로이드 호르몬을 리간드로 인지하고 결합하는 스테로이드 호르몬 핵수용체, 리간드가 알려져 있지 않은 고아 (orphan) 핵수용체, 그리고 연구를 통해 리간드가 밝혀진 adopted orphan 핵수용체 등이 있다. 그 중에서 peroxisome proliferator-activated receptor (PPAR, NR1C1)와 farnesoid X receptor (FXR, NR1H4)는 대표적인 영양분 감지 핵수용체로서, 각각 금식(fasting)과 섭식(feeding) 상황에서 발생하는 내인성 리간드(endogenous ligand)에 의해 활성이 증감한다 (PMID: 28287408). 생리학적 금식 기간 동안의 지방산 산화를 유도하는 PPAR의 경우 섭식 억제 효과가 있는 oleoylethanolamide (OEA)를 포함한 여러 지방산과 인지질의 한 종류인 phosphatidylcholine (C16:0-18:1)등이 내인성 효현제(agonist)로 알려져 있다 (PMID: 12955147, 9113987, 19646743). 또한, 매우 강력한 퍼록시좀 증식(peroxisome proliferation) 효과를 가진 Wy-14,643과 GW7647 등이 합성 PPAR 효현제로써 세포주와 동물실험에 널리 사용되고 있다 (PMID: 4435102, 851495, 2129546, 11354382). 이러한 강력한 퍼록시좀 증식 효과 때문에 PPAR는 퍼록시좀 생성을 조절할 수 있는 master 전사인자로 알려져 있다. 뿐만 아니라, 고지혈증(hyperlipidemia) 환자의 혈중 중성지방을 낮추기 위해 PPAR의 효현제인 fibrate 계열의 약들이 처방되고 있다. 하지만, 최근 연구에 따르면 이러한 fibrate 계열의 약들이 제2형 당뇨병이나 심혈관계 질환을 가진 환자의 사망률을 감소시키지는 않는다고 알려져 있어 혈중 중성지방 감소와 다양한 대사질환과의 상관관계에 대한 더 많은 연구가 필요하다 (PMID: 17316152, 17055933). 한편, FXR의 내인성 효현제는 담즙산의 한 종류인 chenodeoxycholic acid (CDCA)가 있으며, CDCD에 6--ethyl group이 추가된 obeticholic acid (OCA), GW4064 및 fexaramine 등이 CDCA 보다 강력한 합성 FXR 효현제로 알려져 있다 (PMID: 10334992, 10334993, 12166927, 10956205, 1278892). 몇 년 전 생쥐에서 진행된 연구결과에 의하면 인간에는 없는 담즙산인 Tauro--muricholic acid (TMCA)가 FXR의 길항제 (antagonist)로 작용할 수 있다는 것을 증명하였고 이러한 연구결과들에서 유추할 수 있듯이 FXR은 담즙산 항상성 조절에 매주 중요한 전사인자로 알려져 있다 (PMID: 23395169, 11030617). 또한, FXR은 생쥐의 간 절제술 (hepatectomy)에 따른 간 재생과 위소매절제술 (vertical sleeve gastrectomy)에 의한 비만 및 제2형 당뇨병 치료 효과 등에도 매우 중요한 전사인자로 알려져 있어 환자의 FXR을 타겟팅 할 수 있는 리간드의 개발에 많은 관심과 노력이 경주되고 있다 (PMID: 16614213, 24670636). 이러한 노력의 일환으로 2016년 화학 구조 측면에서 FXR의 내인성 리간드인 CDCA와 매우 유사한 OCA가 primary biliary cholangitis (PBC) 환자 치료제로 미국 FDA로부터 승인되었고 OCA를 활용한 다른 간질환으로의 새로운 적응증 확대 연구가 활발히 진행되었다 (PMID: 27532829). 하지만 최근 연구에서는 비알코올성 지방간염 (nonalcoholic steatohepatitis, NASH) 환자의 치료제로서의 OCA 사용이 미국 FDA로부터 거부되어 더욱 효과적이고 부작용이 적은 FXR 리간드에 대한 연구가 절실히 필요한 상황이다 (www.fda.gov).
본 연구자 또한 미국 베일러 의과대학에서 박사후연구원으로 재직할 당시 영양분 감지 핵수용체인 PPAR와 FXR에 대한 새로운 기능, 이른바 자식 작용(autophagy, 오토퍼지) 조절 기전을 밝힌바 있다. 이들 핵수용체는 서로 상반되게 자식 작용(autophagy, 오토퍼지)을 조절할 수 있는데 즉, PPAR는 자식 작용을 유도하는데 필요 및 충분한 전사인자인 반면 FXR은 반대로 자식 작용을 억제하는데 필요 및 충분한 전사인자임을 증명하였다. 또한 이러한 현상은 최소한 PPAR와 FXR이 자식 작용과 관련된 다양한 유전자들의 promoter나 enhancer에 경쟁적으로 결합하고 이에 따라 이들 유전자의 발현을 상반되게 조절함으로써 일어날 수 있다는 기전을 제시하였다. 특히 이 연구결과를 통해 금식 기간 동안 활성화된 PPAR는 퍼록시좀과 미토콘드리아에서 일어나는 지방산 산화를 증가시킬 뿐만 아니라 선택적 자식 작용의 한 종류인 지질 탐식(lipophagy)을 유발시켜 지방 방울(lipid droplet)에 저장되어 있던 중성지방의 분해를 촉진시키고 이를 통해 지방산 산화에 필요한 지방산을 공급할 수 있다는 것을 제시 하였다 (PMID: 25383539). 최근 연구에 의하면 PPAR와 FXR이 분비 단백질 관련 유전자의 발현을 간조직에서 상반되게 조절함으로써 간조직의 에너지 평형상태를 이루는데 중요한 역할을 할 수 있다는 가능성을 제시하였다(PMID: 28249296, 28287408). 아래는 PPAR와 FXR의 영양분 관련 대사 조절을 요약 정리한 그림이다 (그림1).
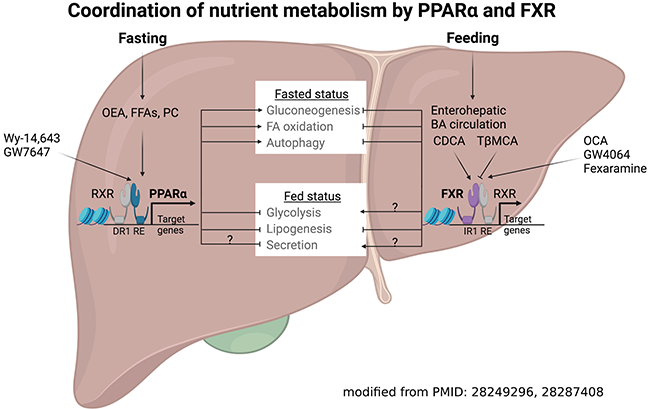
핵수용체 연구에 있어서 내인성 리간드 발굴과 더불어 새로운 표적 유전자를 발굴하는 것은 핵수용체의 생리학적 기능과 역할을 이해하는데 매우 중요하다. 더 나아가 핵수용체의 표적 유전자 발굴은 핵수용체 리간드를 이용한 질병 치료에 있어 원리 증명의 근거로 사용될 뿐만 아니라 핵수용체 리간드가 가질 수 있는 임상적 부작용에 대해서도 미리 예측해 볼 수 있게 한다. 위에서도 언급한 바와 같이 PPAR와 FXR은 이미 합성 효현제가 개발되어 있기 때문에 이들 효현제를 세포주나 실험동물에 처리하면 핵수용체의 전사인자로서의 활성을 극대화 시킬 수 있다. 이를 통해 기존에는 찾기 어려웠던 표적 유전자를 찾아낼 가능성을 높일 수 있다. 따라서 본 연구실에서는 RNA-seq 실험을 통해 PPAR와 FXR의 효현제 처리에 따른 변화된 전사체(transcriptome) 데이터를 확보하였으며, ChIP-seq 실험을 통해 전체 유전체에서 이들 핵수용체가 결합하는 DNA 염기 서열, 즉 시스트롬체(cistrome)를 확보하였다. 리간드 처리 후 막 합성된 nascent RNA의 전사체를 확보하기 위해서는 global nuclear run on-sequencing (Gro-seq)이 기존의 RNA-seq 보다 더 적합하다 (PMID: 19056941, 21549415). 또한 실험적으로 난이도가 높은 ChIP-exo 실험 기법은 핵수용체가 결합하는 DNA 염기 서열의 Peak을 10 ~20 bp 수준의 해상도로 제공하기 때문에 핵수용체가 결합하는 DNA 염기 서열을 보다 정밀하게 확인할 수 있다 (PMID: 22153082). 따라서 이들 핵수용체의 활성에 따른 변화된 전사체와 시스트롬체를 서로 비교 분석하면 매우 용이하면서도 다량의 핵수용체 표적 유전자를 발굴할 수 있다 (PMID: 22930692, 25223782). 이러한 실험 전략은 다양한 실험 조건으로 응용될 수 있으며, 특히 특정 병리상태에서만 발현이 달라지는 핵수용체의 표적 유전자를 발굴한다면 이는 질병 치료에 있어 매우 중요한 기전을 제공할 가능성이 있다. 하지만 위와 같은 실험을 수행할 때 각별히 유의해야 할 점은 연구하고자 하는 핵수용체의 유전자가 결손된 세포주나 실험동물을 negative control 그룹으로 사용해야 한다는 것이다. 이렇게 함으로써 리간드 처리에 따른 핵수용체 의존적 유전자 발현을 비의존적 유전자 발현과 구분을 할 수 있으며 이를 통해 진정한 핵수용체의 표적 유전자를 발굴할 수 있다.
핵수용체의 표적 유전자는 매우 다양하며 신호 및 대사 경로를 조절하는 효소, 막에 존재하는 수용체, 수송체 및 채널, 세포 주기를 조절하는 단백질, 유전자 발현을 조절하는 전사인자 등을 포함하고 있다. 뿐만 아니라, 핵수용체의 표적 유전자로서 내분비 호르몬인 fibroblast growth factor 1 (FGF1), FGF15/19, FGF21, FGF23 등의 발견은 내분비 신호 전달체계의 새로운 장을 펼친 대단한 성과이다 (PMID: 26567701, 26483756). 아래는 특정 핵수용체의 새로운 분비 단백질 관련 표적 유전자를 발굴할 수 있는 실험 전략에 관한 그림이다 (그림2).
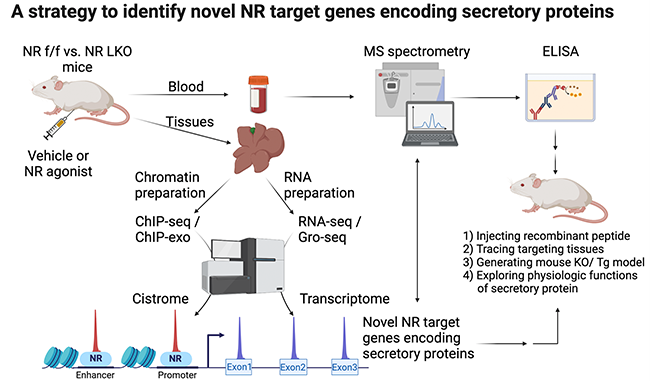
본 연구실에서는 영양분 감지 핵수용체인 PPAR와 FXR의 표적 유전자로서 기존의 알려진 FGF21과 FGF15/19과 같은 새로운 내분비 호르몬을 발굴하고자 노력하고 있으며 최근 그 결실을 맺어가고 있다. 이러한 연구들은 영양분 감지 핵수용체를 표적하는 리간드의 생리학적/병리학적 현상을 설명해 줄 수 있을 뿐만 아니라 새로운 표적 유전자로서의 내분비 호르몬에 대한 더욱 깊이 있는 연구를 가능케 할 것으로 기대된다. 따라서 본 연구실에서는 최종적으로 지용성 리간드에 의한 영양분 감지 핵수용체의 활성 증가에서부터 내분비 단백질 호르몬의 합성 및 분비 촉진에 따른 생리학적 변화에 이르기까지의 새로운 내분비 신호 전달 체계의 축을 확립하고자 한다. 마지막으로 PPAR와 FXR과 관련된 기초 및 임상 공동연구는 항상 환영하며 적극 추진하고자 한다.
본문의 해당문장에 PMID(Pubmed ID)로 표기함.


Copyright(c) Korean Endocrine Society. All rights reserved.